| 上传:邓菘化学 | 审核发布:admin | 更新时间:2016-5-10 19:48:48 | 点击次数:754次 |
Cu+ 2AgNO3 = Cu(NO3)2 + 2Ag
64 2×108
x 15.2g + x
64∶216 = x∶(15.2g + x) 得:x=6.4g
m(Ag) = 9.6g - 6.4g =3.2g
m(Cu)∶m(Ag) = 6.4g∶3.2g = 2∶1
设m g AgNO3溶液中含AgNO3的质量为y,则有:
Cu+ 2AgNO3 = Cu(NO3)2 + 2Ag
64 2×170
6.4 y
64∶340= 6.4∶y 得:y =34g
硝酸银溶液中溶质的质量分数 =![]() ×100%
×100%
49、(2015·湖北十堰)某样品由氧化铜和铜组成,取10.0g该样品与烧杯中,向其中加入192.0g某浓度的硫酸,恰好完全反应,最终所得溶液质量为200.0g,(反应的化学方程式:CuO+H
(1)所取样品中韩铜元素的质量为 g
(2)计算中所得溶液中溶质的质量分数
【答案】(1)8.4g
(2)解:设反应所得硫酸铜的质量为x
CuO+H2SO4=CuSO4+H2O
80 160
200.0g-192.0g x
=
x=16g
所得溶液的溶质质量分数=×100%=8%
答:最终所得的溶液中溶质的质量分数为8%。
【解析】(1)从题目提供的信息可以看出,参加反应的氧化铜的质量=200.0g-192.0g=8.0g,则混合物中铜元素的质量=10.0g-8.0g+8.0g××100%=8.4g;要计算最终所得溶液中溶质的质量分数需要分别知道溶质硫酸铜和溶液的质量,溶液质量已知,现在只需根据CuO+H2SO4=CuSO4+H2O及氧化铜的质量计算出硫酸铜的质量,然后再根据“溶质质量分数=
|
25.(2015•广东)(11分)现有10%的Na2CO3溶液,请按下面要求计算:
(1)106 g上述溶液中所含溶质量为 g;
(2)106 g 上述溶液与足量10%的盐酸反应, 最多可生成CO2多少克?
(3)向106 g 上述溶液中逐滴加入10%的盐酸并不断搅拌,此时发生的反应为:
Na2CO3 + HCl =NaHCO3 + NaCl ;当Na2CO3 全部转化为NaHCO3后,再加入盐酸才
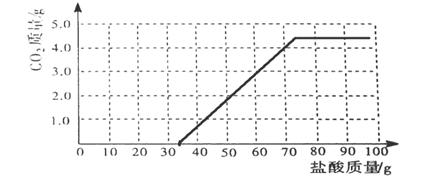
开始放出CO2 。请在“题25图”中画出产生气体的曲线。
(4)另取10% Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:
|
物质 |
Na2CO3 |
HCl |
X |
NaCl |
CO2 |
H2O |
|
质量/g |
31.8 |
14.6 |
16.8 |
23.4 |
4.4 |
m |
 则m= ;该反应的化学方程式为
。
则m= ;该反应的化学方程式为
。
【答案】(1)10.6g (2)4,4g
(3)
(4)1.8
3Na2CO3+4HCl=2NaHCO3+4NaCl+CO2↑+H2O
【解析】106g10%的Na2CO3溶液中溶质的质量为:106×10%=10.6g
解设:生成二氧化碳的质量为x
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 44
10.6g x
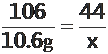
X=4.4g
由反应Na2CO3 + HCl =NaHCO3 + NaCl知,需要消耗盐酸溶液36.5g才开始产生二氧化碳,因此起点是(36.5 0),最后结束生成4.4g二氧化碳,共需要盐酸73g,因此转折点是(73 4.4)
根据质量守恒定律31.8g+14.6g=16.8g+23.4g+4.4g+m m=1.8g
根据化学反应中,物质的质量比等于化学计量数和相对原子质量的乘积的比,可以求出初步的方程式
aNa2CO3+bHCl=x+eNaCl+cCO2↑+dH2O
106a 36.5b 58.5e 44c 18d
31.8g 14.6g 23.4g 4.4g 1.8g 则c=d a=3c b=4c e=4c
所以化学方程式为
3Na2CO3+4HCl=x+4NaCl+CO2↑+H2O 则x为2NaHCO3。
25.(2015•湖南益阳)某同学向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:
|
反应前物质的质量/g |
充分反应后物质的质量/g |
|
|
过氧化氢溶液 |
二氧化锰 |
固体与液体混合物质量 |
|
68.0 |
0.1 |
66.5 |
请计算:
(1)该同学制得氧气的质量为 ▲ 。
(2)该同学所用过氧化氢溶液的溶质质量分数。(相对原子质量:H-1 O-16)
【答案】(1)1.6 g(2分)
|
2H2O2 === 2H2O + O2↑ ……………………(1分)
68 32
x 1.6 g ……………………(1分)
![]() x=3.4 g ……………………(1分)
x=3.4 g ……………………(1分)
![]() …………………………………(1分)
…………………………………(1分)
答:该同学所用过氧化氢溶液的溶质质量分数是5%。
【解析】首先根据质量守恒定律,反应前后物质的质量之差即为反应生成氧气的质量:68.0g+0.1g-66.5g=1.6g。再利用氧气的质量算出参加反应的过氧化氢的质量,进而算出该同学所用过氧化氢溶液的溶质质量分数。
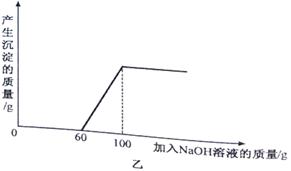
34.(2015·浙江义乌)图甲中A是一种常见的酸,它能与黑色固体B反应,B质量为8克。将NaOH溶液渐渐加入到C中,生成蓝色沉淀E的质量与加入的NaOH溶液的质量关系如图乙所示。在D中加入Ba(NO3)2,溶液能生成一种不溶于稀硝酸的白色沉淀。
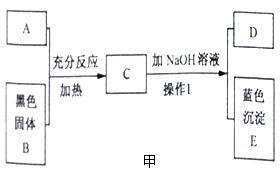
(1)A溶液中溶质的化学式是
(2)操作1的名称是
(3)NaOH溶液中溶质的质量分数是多少?
(4)C溶液中加入NaOH溶液至恰好完全反应时,所得溶液中溶质的质量是多少
【答案】(1)H2SO4 (2)过滤
(3)法一:解:设由CuO生成的CuSO4的质量为x
CuO+H2SO4=CuSO4+H2O
80 160
8g x
80:160=8g:x x =16 g
设与CuSO4反应的NaOH的质量为y,同时生成Na2SO4的质量为a
CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
160 80 142
16 g y a
160:80=16g:y y =8 g
所用氢氧化钠溶液质量分数=8g/(100g-60g)=20%
160:142=16g:a a=14.2 g
(4)设与H2SO4反应的NaOH的质量为b
H2SO4+2NaOH= Na2SO4+ 2H2O
80 142
60×20% b
80:142=12g:b b =21.3 g
所得溶液中溶质的质量为21.3+14.2=35.5g
法二:解:设氢氧化钠溶液的溶质质量分数为x
根据CuO+H2SO4=CuSO4+H2O和CuSO4+2NaOH=Cu(OH)2↓+Na2SO4可以得到关系式:CuO, ~CuSO4~2NaOH
80 80
8g (100g-60g)x
=
x=20%
(2)从图示信息可以看出与稀硫酸和硫酸铜应的氢氧化钠溶液的质量是100g,该溶液中氢氧化钠的质量为:
100g×20%=20g
根据质量守恒定律,恰好完全反应后,氢氧化钠中的钠元素全部转移到了硫酸钠中,因此硫酸钠的质量为:
20g××100%÷×100%=35.5g
答:略
【解析】(1)从题目提供的信息可知,B是氧化铜,根据“D中加入Ba(NO3)2,溶液能生成一种不溶于稀硝酸的白色沉淀”可知,D中一定含有硫酸根离子,则由此确定A是稀硫酸,C是硫酸铜溶液和稀硫酸的混合物,D是硫酸钠溶液,因此A溶液中溶质的化学式H2SO4;(2)操作1是把固体和液体分开的操作,属于过滤操作;(3)氢氧化钠的质量可以先根据氧化铜的质量及CuO+H2SO4=CuSO4+H2O计算出硫酸铜的质量,再根据CuSO4+2NaOH=Cu(OH)2↓+Na2SO4及硫酸铜的质量计算出与硫酸铜反应的氢氧化钠的质量,再根据溶质质量分数公式计算出氢氧化钠的质量分数即可;(4)从图像信息可以看出,氢氧化钠先后与稀硫酸、与硫酸铜发生了化学反应,但最终生成的溶质只有硫酸钠,根据质量守恒定律,先计算出氢氧化钠中钠元素的质量,再结合硫酸钠的化学式计算出硫酸钠的质量。
43.(2015·湖南娄底)马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
|
|
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
|
加入稀盐酸的质量/g |
20 |
20 |
20 |
20 |
20 |
|
生成气体的总质量/g |
1.1 |
2.2 |
m |
4.4 |
4.4 |
试求:
(1)m的值为 64 g(1分)
(2)12g石灰石样品中碳酸钙的质量等于 65 g(2分)
(3)反应完全后最终溶液中氯化钙的质量分数? 66 (3分)
(写出计算过程,计算结果精确至0.1)
【答案】64.3.3(1分) 65. 10 (2分)
66.解:设反应完全后最终溶液中氯化钙的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
111 44
x 4.4g
![]()
x=11.1g ……1分
所求反应完全后最终溶液中氯化钙的质量分数为 [11.1/(10+100-4.4)]×100%=10.5%……2分
【解析】由表格中数据分析可知20g稀盐酸最多只能产生1.1g二氧化碳,第一、二、三次稀盐酸反应完了,碳酸钙没有反应完,所以m=3.3;第四次恰好完全反应,稀盐酸和碳酸钙都反应完了,第五次稀盐酸没有反应,根据生成二氧化碳4.4g,可以求出碳酸钙的质量为10g,也可以求出反应后溶液的溶质质量分数。设反应完全后最终溶液中氯化钙的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
111 44
x 4.4g
![]()
x=11.1g ……1分
所求反应完全后最终溶液中氯化钙的质量分数为 [11.1/(10+100-4.4)]×100%=10.5%。
28. (2015·湖北恩施)我州地处武陵山区,具有丰富的天然石灰石、大理石(主要成分时碳酸钙)资源,纯度高、硬度大,是优质的建筑材料。为测定某地天然大理石中碳酸钙的含量(杂质不与稀盐酸反应),某化学兴趣小组成员取25g样品,加入一定溶质质量分数的稀盐酸,测得的实验数据如图11所示: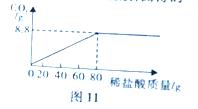
(1)求样品中碳酸钙的质量分数:(2)所加稀盐酸的溶质质量分数。
【答案】解:设碳酸钙的质量为x,氯化氢的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 8.8g
100/44=x/8.8g x=20g
73/44=y/8.8g y=14.6g
样品中碳酸钙的质量分数为20g/25g×100%=80%
盐酸的溶质质量分数为14.6/80g×100%=18.25%
答:样品中碳酸钙的质量分数为80%,盐酸的溶质质量分数为18.25%。
【解析】根据图像可知,样品中的碳酸钙与80g盐酸恰好完全反应时,生成的二氧化碳的质量是8.8g,利用化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑,代入二氧化碳的质量,可求碳酸钙的质量与氯化氢的质量,根据样品质量可求样品中碳酸钙的质量分数,根据溶质质量分数的公式,可求盐酸溶液中溶质的质量分数。
29.(2015·湖北宜昌)(4分)实验室常用石灰石和稀盐酸制取二氧化碳,现取含碳酸钙80%的石灰石12.5g和 94.4g稀盐酸恰好完全反应(石灰石中的杂质不溶于水,也不与稀盐酸反应)。求:
(1)生成二氧化碳的质量;
(2)恰好完全反应后所得溶液中溶质的质量分数。
【答案】解:石灰石中碳酸钙的质量为12.5g×80%=10g
设反应后生成氯化钙的质量为x,生成二氧化碳的质量为y
CaCO3+2HCl= CaCl2+ H2O+CO2↑
100 111 44
10g x y
![]() x=11.1g
x=11.1g
![]() y=4,4g
y=4,4g
反应后溶液中溶质的质量分数=![]()
答:反应后溶液中溶质的质量分数为11.1%.
26. (2015·天津)(7分)某碳酸钠样品含有少量的硫酸钠,取一定质量的该样品,完全溶解在水中配制成100g溶液,将其全部加入到100g一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是195.6g,将溶液蒸干,得到15.6g硫酸钠。
计算:
(1)加入的硫酸溶液的溶质质量分数;
(2)原碳酸钠样品中碳酸钠的质量分数(计算结果精确到0.1%)。
【答案】解:生成二氧化碳的质量:100g + 100g - 195.6g = 4.4g
设样品中Na2CO3的质量为x,反应的硫酸质量为y,生成Na2SO4的质量为z。
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
106 98 142 44
x y z 4.4g
![]()
![]()
![]()
x=10.6g y=9.8g z=14.2g
![]()
硫酸溶液中溶质的质量分数:
原样品的质量为:10.6g+(15.6g-14.2g)=12g
![]() 原样品中碳酸钠的质量分数为:
原样品中碳酸钠的质量分数为:
答:(1)硫酸溶液中溶质的质量分数为9.8%。(2)原样品中碳酸钠的质量分数为88.3%。
【解析】(1)要求所用硫酸的溶质质量分数,题中已经给出硫酸的质量(100g),还需求出溶液中溶质H2SO4的质量。由于该反应过程中会产生二氧化碳气体,产生的气体逸散到空气中会使所得溶液质量减少,故根据质量守恒定律,反应前后溶液的质量差,即为产生的CO2的质量,根据CO2的质量,利用化学方程式计算可以求出参加反应的H2SO4的质量,进而计算硫酸溶液的溶质质量分数。
(2)要想求出原样品中碳酸钠的质量分数,需知道原样品的质量和样品中碳酸钠的质量,而样品的质量,即为碳酸钠质量和原样品中硫酸钠的质量之和。
原样品中碳酸钠的质量,可根据反应生成的CO2的质量,利用化学方程式进行计算。
原样品中硫酸钠的质量=最后所得硫酸钠的质量(15.6g)-反应生成的硫酸钠质量。而反应生成的硫酸钠质量也可通过化学方程式求得。
具体解答过程如下:
解:生成二氧化碳的质量:100g + 100g - 195.6g = 4.4g
设样品中Na2CO3的质量为x,反应的硫酸质量为y,生成Na2SO4的质量为z。
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
106 98 142 44
x y z 4.4g
![]()
![]()
![]()
x=10.6g y=9.8g z=14.2g
![]()
硫酸溶液中溶质的质量分数:
原样品的质量为:10.6g+(15.6g-14.2g)=12g
![]() 原样品中碳酸钠的质量分数为:
原样品中碳酸钠的质量分数为:
16.(2015·湖北孝感)小明喜欢养金鱼,他上网查阅资料得知:鱼缸中每升水的溶氧量低于0.003g时,鱼就会死亡。过氧化钙(CaO2)是一种化学增氧剂,其反应原理是2CaO2+2H2O====2Ca(OH) 2+O2↑请回答:
(1)氧气在水中的溶解度随温度的升高而 。
(2)小明将2.88g过氧化钙放入盛有200L水的鱼缸中,请你通过计算分析,当氧气完全释放后,鱼缸中水的溶氧量是否符合最低要求?(假设产生的氧气完全溶入水,其他因素忽略不计)
16、(1)减小
(2)设2.88gCaO2完全反应生成O2的质量为x.
2CaO2+2H2O=Ca(OH)2+O2↑
144 32
2.88 g x
![]() =
=![]()
x=0.64g
则鱼缸中水的溶氧量为=![]() =0.0032g/L;
=0.0032g/L;
因为0.0032g/L>0.003g/L
所以鱼缸中水的溶氧量符合最低要求.
【解析】(1)气体物质的溶解度随温度的升高而减少;
(2)根据过氧化钙的质量结合化学方程式求出氧气的质量,再由鱼缸中水的质量求出鱼缸中水的溶氧量,并比较进行解答。
28. (2015·山西)某合作学习小组的同学们,欲测定一定量的某种石灰石样品中碳酸钙的质量,进行了如下实验:
(1)配制溶质质量分数为7.3%的稀盐酸。
 ①配制100g溶质质量分数为7.3%的稀盐酸,需图1所示盐酸的质量为___g。
①配制100g溶质质量分数为7.3%的稀盐酸,需图1所示盐酸的质量为___g。
②量取盐酸与水时,视线要与量筒内液体凹液面的___保持水平,再读出液体的体积;将两种液体都倒入____中(填仪器名称),用玻璃棒搅拌,使溶液混合均匀。
(2)将(1)中配制好的稀盐酸加入盛有石灰石样品的烧杯中,产生气体的质量与加入稀盐酸的质量关系如图2所示(假设石灰石样品中的杂质不与稀盐酸反应)。
计算:该石灰石样品中碳酸钙的质量
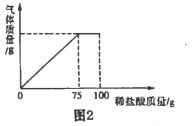
【答案】(1)①20;②最低处;烧杯;(2)7.5g
【解析】(1)①溶质的质量=溶液的质量×溶质质量分数,所以100g溶质质量分数为7.3%的稀盐酸中含盐酸质量为:100g×7.3%=7.3g。需要36% 的盐酸的质量为:7.3g÷36%=20g;
②用量筒量取液体读数时,视线要与量筒内液体凹液面的最低处保持水平;配制溶液的容器是烧杯,所以量取一定体积的36%盐酸和水后直接倒入烧杯中,并用玻璃棒不断搅拌;
(2)从图2中可以看出参加反应的稀盐酸的溶液的质量为75g,根据溶质质量=溶液的质量×溶质质量分数求出参与反应的盐酸的质量,然后代入化学方程式,计算出碳酸钙的质量。
设:石灰石样品中碳酸钙的质量为x
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 73
X 75g×7.3%
![]() =
=![]()
x=7.5g
答:石灰石样品中碳酸钙的质量为7.5g。
32.(2015·湖北武汉)(6分)向盛有氢氧化钠溶液的试管中加入一定量白色的硫酸铜固体粉末,恰好完全反应,过滤,得到溶质质量分数为14.2%的无色溶液10g。请计算:
(1)所得溶液中溶质的质量是 ;
(2)实验前试管中氢氧化钠溶液的质量。
【答案】⑴1.42g;⑵9.38g。
【解析】10g溶质质量分数为14.2%的无色溶液中溶质的质量是10g×14.2%=1.42g。
设硫酸铜固体粉末质量为x,生成的沉淀质量为y。由于反应前后物质的总质量相等,实验前试管中氢氧化钠溶液的质量为(10g+y-x)。
CuSO4+ 2NaOH = Na2SO4+ Cu(OH)2↓
160 142 98
x 1.42g y
![]()
解得,x=1.60g y=0.98g
实验前试管中氢氧化钠溶液的质量:10g+0.98g-1.60g=9.38g。
36.(2015•江苏苏州)(6分)二氧化硫是一种无色具有刺激性气味的气体,它进入大气后可形成硫酸型酸雨。
⑴煤、石油、木柴中都含有硫元素,点燃后均会产生二氧化硫气体,可用 ▲ 溶液检
验该气体的存在。
⑵为减少大气污染,火力发电厂采用以下两种方法吸收废气中的二氧化硫。
①用氨水吸收废气中的二氧化硫,其反应原理可用化学方程式表示为 ▲ 。已知:
亚硫酸盐不稳定,易被空气中的氧气氧化成硫酸盐。
②用石灰石浆吸收废气中的二氧化硫,其反应原理是:
2CaCO3+O2+2SO2![]() 2CaSO4+2CO2 。若1000kg废气中含有1.6kg的二氧化硫,则至少需要含90%碳酸钙的石灰石多少千克才能将其完全吸收(写出解题过程,计算结果保留一位小数)?
2CaSO4+2CO2 。若1000kg废气中含有1.6kg的二氧化硫,则至少需要含90%碳酸钙的石灰石多少千克才能将其完全吸收(写出解题过程,计算结果保留一位小数)?
【答案】 ⑴高锰酸钾 ⑵①4NH3·H2O+2SO2+O2=2(NH4)2SO4+2H2O
或2NH3·H2O+2SO2+O2=2NH4HSO4 ②2.8kg
【解析】(1)高锰酸钾和二氧化硫反应溶液变为无色,因此可用高锰酸钾证明;氨水和二氧化硫反应生成硫酸铵;
② 解:设至少需要含90%碳酸钙的石灰石的质量为x。
2CaCO3 +O2 +2SO2 ![]() 2CaSO4+2CO2
2CaSO4+2CO2
200 128
90%x 1.6kg
200∶128=90%x∶1.6kg
x=2.8kg
答:至少需要含90%碳酸钙的石灰石2.8kg才能将其中的二氧化硫完全吸收。
24.(2015•江西)(10分)为测定某氮肥中硫酸铵的纯度(及质量分数)是否与下图标签相符合,小林取一定量该氮肥样品于烧杯中配成溶液与足量的氯化钡溶液反应,记录有关数据如下表:
|
反应前 |
反应后 |
|
|
烧杯和样品溶液总质量 |
氯化钡溶液质量 |
过滤后烧杯和溶液总质量(滤液的损失忽略不计) |
|
45g |
55g |
76.7g |
【反应的化学方程式为(NH4)2SO4+BaCl2 ==BaSO4↓+2NH4Cl,其他成分能溶于水但不参加反应】
(1)反应生成BaSO4的质量为 g。
 (2)若所取氮肥样品的质量为15g,试通过计算确定该氮肥中硫酸铵的纯度是否与标签相符。(写出计算过程)
(2)若所取氮肥样品的质量为15g,试通过计算确定该氮肥中硫酸铵的纯度是否与标签相符。(写出计算过程)
(3)反应前后,溶液中硫元素的质量 (填“不变:、“增大”或“减小“)。
【答案】(10分)(1)23.3(2分)
(2)解:设样品中硫酸铵的质量为x。
(NH4)2SO4 + BaCl2 ==== BaSO4↓ + 2NH4Cl (1分)
132 233
x 23.3g
132:233=x:23.3g(1分)
解得:x=13.2g(1分)
所以样品中硫酸铵的纯度为![]() ×100%=88%<96%(2分)
×100%=88%<96%(2分)
答:该氮肥中硫酸铵的纯度与标签标注不符。(设、答完整、正确1分)
(3)减少(2分)
【解析】根据质量守恒定律,反应前后物质的总质量不变,所以反应前的总质量等于反应生成沉淀的质量与烧杯及其内容物质的质量之差,要判断该硫酸铵中硫酸铵的纯度是否达标,应该先计算出硫酸铵的纯度,再与标签上的内容比较判断,可根据加入足量氯化钡溶液后,产生沉淀的质量求出样品中硫酸铵的质量,利用硫酸铵的纯度=样品中硫酸铵的质量/样品的质量×100%。根据(NH4)2SO4 + BaCl2 ==== BaSO4↓ + 2NH4Cl 可知,反应前硫元素存在于硫酸铵中,硫酸铵易溶于水,硫元素全部在溶液中,加入氯化钡后,硫元素以硫酸钡形式存在,硫酸钡难溶于水,所以加入氯化钡溶液后,溶液中硫元素的质量减少。
15.(2015•山东菏泽)学习了金属的有关知识后,同学们知道了如何鉴别黄金
和黄铜(铜锌合金,俗名“愚人金”),为进一步定量分析黄铜的成分,某同学进行了如下实验:称量黄铜样品20g放入锥形瓶中,向其中不断加入稀硫酸,收集生成的气体与所加稀硫酸的质量关系如图所示。求:
(1)黄铜样品中锌的质量。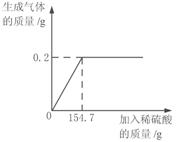
(2)恰好完全反应时,所得溶液中溶质的质量分数。
【答案】(1)6.5g (2)10%
【解析】先根据图示信息判断出完全反应消耗稀硫酸和生成氢气的质量,然后再根据锌与稀硫酸反应的化学方程式分别计算出参加反应的锌和生成的硫酸锌的质量,最后再根据反应后所得溶液质量计算出反应所得溶液的溶质质量分数。
解:设样品中锌的质量为x,生成硫酸锌的质量为 y。由图分析可知产生氢气0.2 g。 1分
Zn + H2SO4 ![]() ZnSO4 + H2↑
ZnSO4 + H2↑
65 161 2
x y 0.2 g 1分
65∶2 = x∶0.2 g x=6.5 g 1分
161∶2 = y∶0.2 g y=16.1 g 1分
所得硫酸锌溶液中溶质的质量分数:
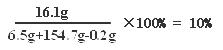 2分
2分
答:(1)样品中锌的质量为6.5g。
(2)所得硫酸锌溶液中溶质的质量分数为10%。
18. (2015·内蒙古呼和浩特)向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示:
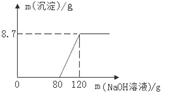
(1)计算氢氧化钠溶液的溶质质量分数;
(要求写出计算过程)
(2)与氢氧化钠溶液反应所消耗硫酸溶质的质量为________克。
【答案】
(1)30% (2)29.4g
【解析】
(1)解:设与硫酸镁反应消耗NaOH的质量为x
2NaOH+MgSO4=Mg(OH)2↓+Na2SO4
80 58
x 8.7g
![]()
X=12g
NaOH%=![]() ×100%=30%
×100%=30%
答:氢氧化钠溶液的溶质质量分数为30%
(2)设与氢氧化钠溶液反应所消耗硫酸溶质的质量为y,则
2NaOH + H2SO4=2H2O+Na2SO4
80 98
80g×30% y
![]()
y=29.4g
答:氢氧化钠溶液的溶质质量分数为30%,与氢氧化钠溶液反应所消耗硫酸溶质的质量为29.4g.
43、(2015·湖北荆州)(6分)如图是某胃药标签的部分内容。小明同学测定该药品中NaHCO3含量的过程如下:取10粒该药剂研碎后放入烧杯中,加入50克水后充分搅拌,再向其中滴加稀盐酸至溶液的pH=7时(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5克。称得反应后烧杯内物质的总质量为64.3克。
|

请计算:(1)反应完成后生成气体的质量为 g。
(2)反应后烧杯中溶液的质量和胃药中NaHCO3的质量分数。
【答案】(1)2.2g (2)84%
【解析】
解:(1)每粒0.5g,10粒该药剂的质量为0.5g×10=5g.
由质量守恒定律,生成二氧化碳气体的质量为5g+50g+11.5g﹣64.3g=2.2g.
(2)设参加反应的碳酸氢钠的质量为x,
NaHCO3+HCl=NaCl+H2O+CO2↑
84 44
x 2.2g
![]() x=4.2g
x=4.2g
反应后烧杯中溶液的质量为4.2g+50g+11.5g﹣2.2g=63.5g.
胃药中NaHCO3的质量分数为![]() ×100%=84%.
×100%=84%.
答:(1)2.2g;(2)反应后烧杯中溶液的质量为63.5g;胃药中NaHCO3的质量分数为84%.
点评: 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.
(2015·四川南充)16.实验室有不纯的氯酸钾样品12.5g,把该样品与少量二氧化锰混合加热制取氧气(杂质不参加反应),充分反应后,固体混合物质量变化如下所示:
|
反应前固体总质量 |
反应后固体总质量 |
|
13.5g |
8 .7g |
(1)生成氧气的质量为_________g。
(2)氯酸钾在样品中的质量分数是多少?
【答案】(1)4.8
(2)解:设样品中氯酸钾的质量为x
2KClO3 ![]() 2KCl + 3 O2 ↑
2KCl + 3 O2 ↑
245 96
x 4.8g
245/96=x/4.8g
x=12.25g
样品中氯酸钾的质量分数为:12.25g/12.5g×100%=98%
答:氯酸钾在样品中的质量分数是98%
【解析】(1)反应前后固体物质质量减轻,减轻的质量就是生成的氧气的质量:13.5g-8.7g=4.8g
(2)根据氯酸钾制取氧气反应的化学方程式求出样品中氯酸钾的质量,然后除以样品质量就可求出样品中氯酸钾的质量分数。
18. (2015•山东济宁)(4分)低钠盐是一种健康食盐,以普通钠盐为基础添加一定量氯化钾(氯化钠70%左右,氯化钾30%左右),有助于人体钠、钾平衡,降低高血压、心血管疾病的患病风险。另外,由于食盐中导致咸味的是氯离子,因此,低钠盐能较好实现减钠补钾不减味的目的。

课外探究小组为调查市售低钠盐是否合格,选用一种常见低钠盐进行实验分析:
步骤一:用电子天平准确称取低钠盐样品2.00 g,
放入洁净小烧杯中加水,搅拌至样品充分溶解;
步骤二:向上述小烧杯中逐渐加入足量的硝酸银溶液,边滴边搅拌至不再生成沉淀为止;
步骤三:将沉淀经过滤、干燥后,称量沉淀质量为4.51 g。
(1)某同学参照样品配比,计算出2.00 g低钠盐样品中氯化钠(氯化钠70%)与硝酸银反应所得沉淀的质量为3.43 g。请你计算出样品中氯化钾与硝酸银反应所得沉淀的质量;
(简单写出计算过程,计算结果精确到0.01)
(2)经计算,你认为样品是否合格?_____________;
(3)课外探究小组在教师指导下,取同质量样品经再次精确实验,最终得到沉淀的质量为4.56 g。比较两次实验所得沉淀的质量,请分析造成误差的主要原因。
【答案】(1)1.16![]() (2)合格 (3)沉淀的干燥程度不同、干燥时有部分固体飞溅(合理即可)
(2)合格 (3)沉淀的干燥程度不同、干燥时有部分固体飞溅(合理即可)
【解析】
(1)解:由题意知,样品中氯化钾的质量为![]()
![]() ,
,
设:由样品中氯化钾与硝酸银反应所得沉淀的质量为![]()
![]() ··················(1分)
··················(1分)
74.5 143.5
0.60![]()
![]()
即:![]()
计算得:![]() ≈1.16
≈1.16![]() ····························(1分)
····························(1分)
(2)由题意可知,低钠盐中含氯化钠70%左右,氯化钾30%左右,该同学称量的2.00 g低钠盐样品中含氯化钠70%,故为合格的。
(3)2.00 g低钠盐样品与硝酸银反应所得沉淀的质量为3.43 g+1.16g=4.59g,该课外探究小组通过实验得到沉淀的质量为4.56 g,沉淀质量偏小,可能是因为沉淀的干燥程度不同、干燥时有部分固体飞溅等。
40.(2005·湖北荆门)(5分)某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如右表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。根据实验数据计算:
(1)表中 n的数值为 。
|
实验次数 |
加入稀盐酸的质量/g |
剩余固体的质量/g |
|
1 |
20 |
15 |
|
2 |
20 |
10 |
|
3 |
20 |
6.8 |
|
4 |
20 |
n |
(2)样品中碳酸钙的质量分数是 。
(3)求盐酸中溶质的质量分数。
【答案】(1) 6.8 (2)66% (3)由试题分析20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应。
解:设盐酸溶液中溶质的质量分数为x。
CaCO3 + 2HCl =CaCl2+H2O+CO2↑
100 73
5g 20g× x
100∶73= 5g∶(20g× x)
x=18.3%
答:盐酸溶液中溶质的质量分数为18.3%
【解析】(1)从题目提供的信息可以看出,在第1次和第2次向石灰石样品中加入稀盐酸时,固体质量都减少了5g,说明在前两次中稀盐酸都已经完全反应,在第3次中,虽然又加入了20g稀盐酸,但反应掉的固体质量只有3.2g,说明该反应中碳酸钙已经用完,因此第4次,剩余固体的质量仍然是6.8g;(2)石灰石样品中碳酸钙的质量分数=×100%=66%;(3)根据与20g稀盐酸完全反应的碳酸钙质量及碳酸钙与稀盐酸反应的化学方程式,可以计算出20g稀盐酸中氯化氢的质量,再用参加反应的氯化氢的质量除以20g稀盐酸的质量乘以100%便可计算出所用稀盐酸的质量分数。
16、(6分)(2015·安徽)非物质文化遗产“芜湖铁画”(镀金)含有金、铁(其他成分忽略不计)。某同学取一定质量的铁画边角料,加入足量稀盐酸,充分反应后,放出0.3g H2,剩余固体质量为0.1g。
(1)求样品中铁的质量。
(2)求样品中金的质量分数。
16、解:(1)设样品中铁的质量为x
Fe+2HCl==FeCl2+H2↑
56 2
x 0.3g
=
解得x=8.4g
(2)样品中金的质量分数=×100%≈1.2%
答:样品中铁的质量为8.4g;样品中金的质量分数为1.2%。
【解析】(1)根据氢气的质量,有化学方程式可求出样品中铁的质量;
(2)铁画中铁与稀盐酸反应产生氢气,而金不反应,所以充分反应后剩余固体就是金的质量,样品的质量就是铁的质量与金的质量之和,可进一步求出样品中金的质量分数。
33、(8分)(2015·山东济南)1926年我国著名化学家侯德榜先生创立了侯氏制碱法促
进了我国民族工业的发展和世界制碱技术的进步,其生产过程中有下列反应。
(1)侯氏制碱法所制的“碱”是指_______________。
(2)工业生产过程中氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,在常温下,两者首先从溶液中结晶析出的是_________ 晶体(填物质名称)。
(3)现有Na2CO3和NaCl的混合物样品22.3g,将其放入干净的烧杯中,加一定质量的水使其完全溶解。向所得溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如上图所示。试回答F列问题
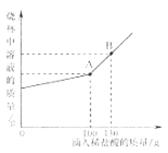
①当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为_______________写化学式。
②在Na2CO3和NaCl的混合物样鼎中,含Na2CO3的质量为_______________g。
③当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g)。
33、(1)纯碱
(2)碳酸氢钠
(3)①NaCl、HCl
②设样品中碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3 + 2HCl = 2NaCl+H2O+CO2↑
106
73
117
X 100g×7.3% y
![]() ,
, ![]() ,
,
X=10.6g y=11.7g
③当滴入稀盐酸至A点时,所得不饱和溶液的溶质质量为22.3g-10.6g+11.7g=23.4g
【解析】(1)侯氏制碱法制得的“碱”是指纯碱;
(2)与氯化铵相比,碳酸氢钠溶解度相对较小,所以在溶液中首先结晶析出的是碳酸氢钠;
(3)①当滴入稀盐酸至A点时,所加盐酸正好与碳酸钠反应,当滴入稀盐酸至B点时,稀盐酸过量,烧杯溶液的溶质为氯化钠和稀盐酸;
②当滴入稀盐酸至A点时,所加盐酸正好与碳酸钠反应,此时根据盐酸的质量利用化学方程式,求出碳酸钠的质量;
③此时所得溶液为氯化钠溶液,求出氯化钠的质量、生成二氧化碳的质量,所得不饱和溶液的溶质质量为原样品中氯化钠的质量与生成氯化钠质量之和,也就是溶液质量。
11、(2015·山东济南)烧杯中有一定质量的MgO和MgCO3的混合物,向其中加入150g稀盐酸,恰好完全反应。一定温度下,得到156g不饱和溶液。下列数据中与该溶液的溶质质量分数最接近的是
A. 16.6% B.6.1% C.12.2% D.9.1%
11、D【解析】此题考查根据质量差进行计算。由碳酸镁与盐酸反应化学方程式MgCO3+2HCl=MgCl2+CO2↑+H2O可知,二氧化碳出来后,相当于氧化镁与盐酸反应,因而增加的质量就是氧化镁的质量156g-150g=6g,所以设生成氯化镁的质量为x
MgO+2HCl=MgCl2+H2O
40 95
6g x
![]() x=14.25g
x=14.25g
所以该溶液的溶质质量分数=![]() .
.
15.(2015·湖北随州)将质量为22.3g的氯化钠和纯碱的固体混合物完全溶于131.4g水中,加入一定溶质质量分数的氯化钡溶液,所加氯化钡溶液质量与生成沉淀的质量变化关系如图所示。请完成以下问题: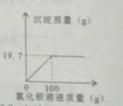
⑴恰好完全反应时生成沉淀的质量是 g。
⑵计算所得溶液中溶质的质量分数是多少?(溶液中无晶体析出)
【答案】⑴19.7g
⑵解:设参加反应的Na2CO3的质量为x,生成NaCl的质量为y
Na2CO3 +BaCl2=BaCO3↓+2NaCl
106 197 117
X 19.7g y
![]()
![]()
X=10.6g y=11.7g
则溶液中溶质质量分数为:
![]()
答:溶液中溶质质量分数为10%
【解析】(1)由坐标图曲线可知,生成沉淀的质量为19.7g;(2)根据化学方程式生成氯化银的质量19.7g,可以求出纯碱的质量,以及生成氯化钠的质量,反应后溶液的质量为固体混合物+水的质量+氯化钡溶液的质量-生成的沉淀的质量,答案为⑴19.7g
⑵解:设参加反应的Na2CO3的质量为x,生成NaCl的质量为y
Na2CO3 +BaCl2=BaCO3↓+2NaCl
106 197 117
X 19.7g y
![]()
![]()
X=10.6g y=11.7g
则溶液中溶质质量分数为:
![]()
答:溶液中溶质质量分数为10%
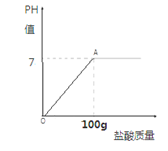 57. (2015•四川乐山)(7分)
57. (2015•四川乐山)(7分)
在含氯化钠杂质的纯碱13.6g中逐渐加入质量分数为7.3%的稀盐酸,所加稀盐酸的质量关系如右图所示:
(1)100g稀盐酸中氯化氢的质量
(2)完全反应后,所得溶液中溶质的质量分数?
【答案】(1)7.3g(2分) (2)13.5%
【解析】 (1)100g稀盐酸中氯化氢的质量=100g×7.3%=7.3g(2分)
(2)解:设反应中碳酸钠、氯化钠、二氧化碳的质量分别为X、Y、Z,则
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O (1分)
106 73 117 44
X 7.3g Y Z
106 : 73= X: 7.3g X=10.6g (1分)
73 : 117= 7.3g : Y Y=11.7g (1分)
73 : 44= 7.3g : Z Z= 4.4g (1分)
所得溶液的质量分数=( 11.7+3)g/(13.6+100-4.4)g = 13.5% (2分)
答:所得溶液的质量分数为13.5%。
38.(2015·四川泸州)过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:
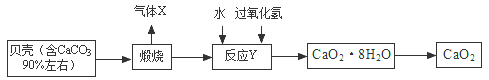
(1)气体X是CO2,其名称是 ;将过氧化钙晶体与溶液分离的方法是 。
(2)反应Y需控制温度在0~5℃,可将反应容器放在 中,该反应是化合反应,反应产物是CaO2·8H2O,请写出化学方程式 。获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 。
(3)CaO2的相对分子质量为 ,过氧化钙晶体﹝CaO2·8H2O﹞中H、O元素的质量比为 。
(4)为测定制得的过氧化钙晶体中CaO2·8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220℃充分反应(方程式为2CaO2·8H2O2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。
【答案】(1)二氧化碳 过滤(2) 冰水混合物 CaO2+H2O2+7H2O=CaO2·8H2O CaO或Ca(OH)2过量,且Ca(OH)2微溶(3)72 1∶10
解:设样品中CaO2·8H2O的质量为x
2CaO2·8H2O2CaO+O2↑+16H2O↑
432 32
x 3.2g
![]()
![]()
∴x=43.2g
∴ 样品中CaO2·8H2O的质量分数为![]() =86.4%
=86.4%
答:样品中CaO2·8H2O的质量分数为=86.4%
【解析】(1)气体X是CO2,其名称是二氧化碳;将固体与溶液分离的方法是;(2)由于反应Y需控制温度在0~5℃,所以可以将反应容器放在冰水混合物中,由于该反应是化合反应,反应产物是CaO2·8H2O,所以化学方程式为CaO2+H2O2+7H2O=CaO2·8H2O;由于氧化钙会与水反应生成氢氧化钙,且氢氧化钙微溶于水,所以获得的过氧化钙晶体中常含有Ca(OH)2杂质;(3)CaO2的相对分子质量为40+16×2=72,过氧化钙晶体﹝CaO2·8H2O﹞中H、O元素的质量比为(1×2×8):(16×10)=1:10;(4)根据化学方程式2CaO2·8H2O2CaO+O2↑+16H2O↑,通过生成3.2g氧气,可以求出过氧化钙晶体中CaO2·8H2O的质量,即可算出样品中CaO2·8H2O的质量分数;解:设样品中CaO2·8H2O的质量为x
2CaO2·8H2O2CaO+O2↑+16H2O↑
432 32
x 3.2g
![]()
![]()
∴x=43.2g
∴ 样品中CaO2·8H2O的质量分数为![]() =86.4%
=86.4%
答:样品中CaO2·8H2O的质量分数为=86.4%
23. (2015·山东聊城)(10分)现将1og铜锌(Cu-Zn)合金放入到一定质量的稀硫酸中怡好完全反应,过滤得到10og溶质质量分数为16.1%的溶液。据此请完成下列问题:
(1)生成氢气______g;
(2)稀硫酸中H2SO4的质量是_______g;
(3)合金中铜的质量分数是多少?
【答案】(1)解:设生成氢气的质量为x,稀硫酸中溶质的质量为y,合金中锌的质量为z。
Zn+ H2SO4 === ZnSO4 + H2↑
65 98 161 2
z y 100g×16.1﹪ x
65:z=161:(100g×16.1﹪)
z=6.5g
98:y=161:(100g×16.1﹪)
y=9.8g
2:x=161:(100g×16.1﹪)
x=0.2g
合金中铜的质量分数=(10g-6.5g)/10g×100﹪=35﹪
答:生成氢气的质量为0.2g;稀硫酸中溶质的质量为9.8g;合金中铜的质量分数为35﹪。
【解析】此题考查化学方程式的计算。先计算出反应后溶液中硫酸锌的质量,然后根据化学方程式即可计算出氢气和硫酸的质量;最后用铜的质量除以样品的质量即可得出合金中铜的质量分数。
55.(2015·四川巴中)某化肥厂排放的废水中含有一定量的氢氧化钾,为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其他杂质不与盐酸反应)。现取50g废水于锥形瓶中,逐滴加入2%的稀盐酸至恰好完全反应时,消耗稀盐酸7.3g,求废水中的氢氧化钾的质量分数。
【答案】55.解:设50g废水中氢氧化钾的质量是x
HCl + KOH== KCl + H2O
36.5 46
7.3g×2% x
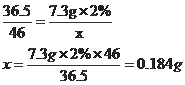
废水中氢氧化钾的质量分数是:0.184g/50g×100%=0.368%
答:废水中氢氧化钾的质量分数是0.368% 。
【解析】正确算出参加反应的溶液中溶质的质量,代入化学方程式进行计算。
17. (2015•四川广安)测定石灰石中的碳酸钙的含量取出2.5克石灰石样品,逐滴加入稀盐酸充分反应后测得剩余固体质量与加入稀盐酸的质量关系如图所示。
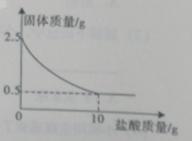
(已知:CaCO3+2HCl==CaCl2+H2O+CO2↑杂质不参加反应,也不溶于水)
(1)石灰石样品中碳酸钙的质量是 g
(2)石灰石样品中碳酸钙的质量分数是
(3)计算稀盐酸溶质的质量分数。
【答案】(1)2(2)80%(3)14.6%
【解析】有图题意可知固体的质量随着盐酸加入不断减少,当盐酸加入到10g固体的质量为.5g质量不再减少,减少的质量为参加反应的碳酸钙的质量2.5g-0.5g=2g;碳酸钙的质量分数为:![]() =80%;
=80%;
解:设10g稀盐酸中溶质的质量为x
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 73
2g x
![]() =
=![]() x=1.46g
x=1.46g
![]() =14.6%
=14.6%
答:所用盐酸的溶质的质量分数14.6%
28. (2015•广东佛山)(7分)某腐蚀印刷电路板的废液中含有CuCl2和FeCl2,为了分析该废液的组成,取1 000 g废液,设计如下实验方案进行探究:
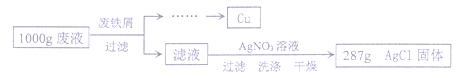
实验过程中加入废铁屑的质量、析出Cu的质量的数据记录如下表:
|
废铁屑的质量/g |
20 |
40 |
60 |
80 |
|
析出Cu的质量/g |
12.8 |
25.6 |
32 |
32 |
(注:废铁屑中的杂质不溶于废液也不与废液反应,不考虑过滤中的损失。)
(1)1 000 g废液与足量废铁屑完全反应,析出Cu的质量为 。
(2)废铁屑中单质Fe的质量分数为 。
(3)计算1 000 g废液中CuCl2的质量分数。(写出计算过程,结果保留小数点后一位)
(4)1 000 g废液中FeCl2的质量分数为 。(结果保留小数点后一位)
【答案】(1)32g (2)56% (3)6.75% (4)6.4%(6.35%亦可)
【解析】根据表格中数据规律可知,当废铁屑的质量达到60g以上时,析出铜的质量便不再增加,说明1000g废液中最终所析出的金属铜的质量为32g;根据废铁屑与废液反应析出铜的质量可求出参加反应的铜的质量,注意所选数据一定要是铁全部参与反应的实验组的数据,可根据20g废铁屑与12.8g铜或40g废铁屑与25.6g铜这两组数据进行计算,不可选用后面的两组数据,根据数据显示的规律可以判断,后两组实验中,废铁屑没有完全参与反应;最终结合相关数据关系,依据化学方程式分别求出参加反应的氯化铜的生成的氯化亚铁的质量。
50.(2015·上海)实验室用氯酸钾和二氧化锰的混合物制取氧气,某次实验中固体的质量变化如下:

①生成氧气的质量是 g,其物质的量为 mol。
②求参加反应的氯酸钾的物质的量。(根据化学方程式列式计算)
【答案】①4.8 0.15②解:设参加反应的氯酸钾的物质的量为x
2KClO3
![]() 2KCl+3O2↑
2KCl+3O2↑
2 3
X 0.15mol
2;x=3:0.15mol x=0.1mol
答:略
【解析】根据质量守恒定律可知产生氧气的质量未15g+5g-15.2g=4.8g,据此进行有关化学方程式的计算。
32.(2015·浙江宁波)某地规定工业排放的废气中S02的含量不得超过0.4mg/L。某兴趣小组利用以下反应:S02+I2+2H20=H2S04+2HI,测定某工业废气中S02的含量,测试装置如图所示。
|
实验次数 |
金属质量(g) |
金属氧化物质量(g) |
|
l |
45.0 |
84.9 |
|
2 |
45.0 |
85.1 |
|
3 |
45.0 |
85.O |
|
平均值 |
45.0 |
m |
测试步骤:
①碘溶液的配制:准确称取l.27g碘单质,加入少量碘化钾,先溶解在100mL水中,继续加水配制成l000mL溶液。
②取5mL上述溶液,加入试管中,滴入2~3滴淀粉试液。
③把l00mL注射器的活塞推到底后,插入试管的橡皮塞中,如图所示。
然后缓缓向外拉,使吸入试管内的废气与淀粉碘溶液充分接触。每次抽取的气体为l00mL,重复抽取n次,直到溶液的颜色变为无色(废气中的其它成分不与淀粉碘溶液反应)。
(1)排放到空气中的S02气体主要来自于 ▲ 燃烧。
(2)步骤②中,5mL溶液中溶有碘单质 ▲ mg,滴入淀粉试液后,溶液变为 ▲ 色。
(3)按步骤测试某工业废气,抽取次数为80次后,溶液刚好变为无色。试计算该废气中S02含量,并判断是否符合排放标准。

【答案】(1)化石燃料 (2)6.35;蓝 (3)0.2mg/L<0.4mg/L,排放达标。
【解析】(1)大气中的S02主要是煤、石油燃烧产生的,它们都属于化石燃料。
(2)碘单质是1.27g=1270mg,1270mg×5mL/1000mL=6.35mg
(3)解:设抽80次(即8000mL)废气中的S02质量为x
S02 + I2 + 2H20 = H2S04 +2HI
64 254
X 6.35mg
64/x=254/6.35mg
x=1.6mg
100mL/次×80次=8000mL=8L
1.6mg/8L=0.2mg/L。
因为0.2mg/L<0.4mg/L,所以排放达标。
(2015·山东临沂)31.黄铜(铜锌合金)是重要的金属材料,常用来制造机械零件、仪表和日用品。为测定某黄铜材料中锌的含量,化学研究小组进行了实验:称取15.0 g此黄铜材料,向其中逐渐加入稀盐酸,测定产生气体的质量和加入稀盐酸的质量,并根据实验情况绘制了产生气体质量与加入稀盐酸质量的关系图。
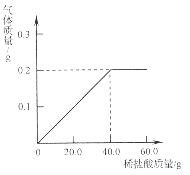
请你仔细分析此关系图。并进行计算:
(1)15.0g黄铜材料中含锌_______________g。
(2)稀盐酸中溶质的质量分数(写出计算过程,计算结果精确到0.1%)。
【答案】 解:设黄铜材料中锌的质量为x,40g稀盐酸中溶质的质量为y。
Zn + 2HCl = ZnCl2 + H2↑
65 73 2
x y 0.2g
65:2=x:0.2g
x =6.5g
73:2=y:0.2g
y =7.3g
稀盐酸中溶质的质量分数=7.3g/40.0g×100%≈18.3%
答:稀盐酸中溶质的质量分数为18.3%。
【解析】通过坐标图可以得出样品中锌完全反应产生0.2g氢气,根据产生的氢气的质量结合化学方程式可计算出锌的质量和40.0g稀盐酸中溶质的质量,然后即可通过溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
(2015•福建福州)18. (4分)某碳酸钠样品中混有少量氯化钠,根据图II所示信息计算,该样品中碳酸钠的质量分数。(计算结果精确到0. 1 %)
(反应的化学方程式:CaCl2 + Na2CO3 = CaCO3↓+2NaCl )
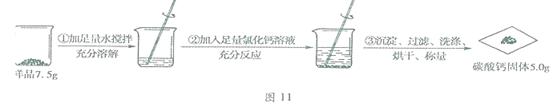
【答案】70.7%
【解析】解:设该样品中碳酸钠的质最为x
CaCl2+Na2CO3==NaCl+CaCO3↓
106 100
X 5.0g
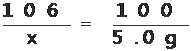
X=5.3g

答:该样品中碳酸钠的质量分数为70.7%。
25.(2015·重庆B卷)(7分)取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16 .4g ,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失)。计算:
(1)生成氧气的质量。
(2)二氧化锰的质量。
(3)氯化钾溶液中水的质量。
【答案】⑴9.6g;⑵1.5g;⑶134.1g。
【解析】(1)生成氧气的质量为26g-16.4g=9.6g;
(2)设:原混合物中氯酸钾的质量为x,生成氯化钾的质量为y
2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
245 149 96
x y 9.6g
![]()
![]()
解得x=24.5g y=14.9g
所以二氧化锰的质量为26g—24.5g=1.5g
(3)根据题意易知氯酸钾已全部分解,生成氯化钾的质量为14.9g
所以氯化钾溶液质量为![]()
氯化钾溶液中水的质量为149g—14.9g=134.1g
答:(1)生成氧气质量为9.6g
(2)二氧化锰的质量为1.5g
(3)氯化钾溶液中水的质量为134.1g
(2015·山东泰安)29.(6分)我市盛产石灰石,主要成分是CaCO3。某同学为了测定石灰石中碳酸钙的质量分数进行了如下实验。取一量的石灰石样品研碎和100g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25g)。
|
反应时间/s |
20 |
40 |
60 |
80 |
100 |
|
烧杯和药品质量/g |
137.8 |
135.6 |
m |
134.5 |
134.5 |
请计算:(1)表中的“m”为____________g。
(2)该石灰石样品中碳酸钙的质量分数。(计算结果情确至0.1%)
【答案】(1)134.5
(2) 解:设样品中碳酸钙的质量为x
减少的质量正是生成二氧化碳的质量,生成二氧化碳的质量是5.5g
CaCO3+ 2HCl ![]() CaCl2 + CO2↑+ H2O
CaCl2 + CO2↑+ H2O
100 44
x 5.5g
100/44=x/5.5g
x=12. 5g
样品的质量为:134.5g+5.5g-100g-25g=15g
样品中碳酸钙的质量分数为12.5g/15g×100%≈83.3%
答:样品中碳酸钙的质量分数为83.3% 。
【解析】(1因为反应匀速进行,20s时减少2.2g,40s时减少4.4g,一次类推,60s时烧杯和药品的质量应该为133.4g,而表中数据中80s、100s时的质量都是134.5g,所以未到60s时反应已经停止进行,m的值为134.5g。(2)根据减少的二氧化碳的质量可以求出参加反应堆碳酸钙的质量,然后列式计算即可。
17.(2015•四川宜宾)有关资料介绍,制取氧气有多种方法,其中氧化铜与氯酸钾混合加热,也能很快产生氧气。现将2.5g氧化铜与24.5g氯酸钾的混合物充分加热,残余固体经冷却、称量、质量为17.4g。然后将固体溶于65.1 g水中,充分搅拌,过滤得到滤液和黑色的滤渣。滤渣又经过洗涤、烘干、称量,质量为2.5g。(不考虑过程中物质的损失,计算结果保留一位小数)
(1)该反应中氧化铜起 作用。
(2)生成的氧气为 克。
(3)所得滤液中溶质是 ,其质量分数为 。
(4)向所得滤液中加入质量分数为16%的AgNO3溶液恰好完全反应,需AgNO3溶液的质量为多少克?(列出必要的计算过程)
【答案】(1)催化 (2)9.6 (3)氯化钾 18.6%
(4)设需要AgNO3的质量是x
KCl + AgNO3 === AgCl↓ + KNO3
74.5 170
14.9g X
![]()
![]()
需要AgNO3溶液的质量是:![]()
答:需要AgNO3溶液的质量是225g。
【解析】(1)由题目分析可知氧化铜在该反应中质量没有改变,加快了化学反应,得出在该反应中起催化作用;(2)根据质量守恒定律可知生成氧气的质量为:2.5g+24.5g-17.4g=9.6g;(3)根据质量守恒定律可知所得滤液为KCl的溶液,其中质量为14.9g,溶质的质量分数为![]() ;(4)根据化学方程式中氯化钾的质量可求出硝酸银的质量;设需要AgNO3的质量是x
;(4)根据化学方程式中氯化钾的质量可求出硝酸银的质量;设需要AgNO3的质量是x
KCl + AgNO3 =AgCl↓ + KNO3
74.5 170
14.9g X
![]()
![]()
需要AgNO3溶液的质量是:![]()
答:需要AgNO3溶液的质量是225g。
25. (2015·重庆A卷)(7分)硫酸锌溶液可以作木材防腐剂。工业上常用红锌矿(主要含ZnO)和稀硫酸为原料制取硫酸锌,化学反应方程式为:H2SO4 +ZnO=ZnSO4+ H2O。计算:
(1)硫酸锌中锌元素、硫元素和氧元素间的质量比为___________。
(2)如果用100g溶质质量分数为1%的硫酸锌溶液配制10%的硫酸锌溶液,需要加入多少克硫酸锌固体?
(3)取50kg某红锌矿与足量稀硫酸充分反应,最后得到80.5kg硫酸锌,则红锌矿中氧化锌的质量分数是多少?(假设红锌矿中的杂质不与稀硫酸反应)
【答案】⑴65:32:64;⑵10g;⑶81%。
【解析】(1)硫酸锌中锌元素、硫元素和氧元素间的质量比=65:32:16×4=65:32:64
(2)设:需要加入硫酸锌固体的质量为 m,根据配制前后硫酸锌的质量相等,可知
100g×1%+m=(100g+m)×10%
m=10g
(3)设红锌矿中含有氧化锌的质量为 x
ZnO + H2SO4 = ZnSO4 + H2O
81 161
x 80.5kg
![]()
解得:x=40.5kg
红锌矿中氧化锌的质量分数为![]() =81%
=81%
答:需要加入硫酸锌固体的质量为 10g; 红锌矿中氧化锌的质量分数为 81% 。
24.(2015·广东揭阳)某铝制品的主要成分是Al和Cu,课外小组将200gNaOH溶液不断地加到50g铝制品中得到如下数据
(已知金属铝既可以跟强酸反应也可以与强碱反应,而金属铜不能与强碱反应,铝与NaOH溶液反应的化学方程
式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑)
|
实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
|
加入氢氧化钠溶液的质量/g |
50 |
50 |
50 |
50 |
|
剩余固体的质量/g |
36.5 |
23 |
9.5 |
9.5 |
请回答以下问题(1)该50g铝制品中含有 g铜。
(2)求所用氢氧化钠溶液的溶质质量分数为多少?
【答案】(1)9.5
(2)解:设所用氢氧化钠的质量为x
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54 80
13.5g x
54 80
![]()
![]() 13.5 g
= x
13.5 g
= x
解得x=20g
NaOH%=20g/50g×100%=40%
答:所用氢氧化钠溶液的溶质质量分数为40%
【解析】(1)根据题意可知,金属铜不能与强碱反应,所以反应后剩余的的9.5g固体质量是铜的质量;
(2)第一次加入50g溶液全部反应,消耗的铝的质量为50g-36.5g=13.5g,根据化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑,代入铝的质量可求氢氧化钠的质量,再利用溶质质量分数的公式求出氢氧化钠溶液中溶质质量分数。
15. (2015·贵州黔东南)某化学兴趣小组对某铜锌合金样品进行探究实验。称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示。求:
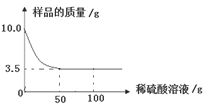
(1)铜锌合金中,Zn的质量分数是 。
(2)所用稀硫酸溶液中溶质的质量分数是多少?
【答案】(1)65% ;(2)19.6%。
【解析】(1)根据图像可知完全反应后剩余固体质量为:3.5g,铜锌合金样品中锌能与稀硫酸反应,而铜不能与稀硫酸反应,所以剩余固体质量为铜的质量为3.5g,因此,锌的质量为:10g-3.5g=6.5g,所以,铜锌合金中,Zn的质量分数是![]() ×100%=65%;
×100%=65%;
(2)根据锌的质量计算参加反应的稀硫酸的质量,然后除以参与反应的50g稀硫酸溶液的质量就可得出所用稀硫酸溶液中溶质的质量分数是多少。
设反应中消耗稀硫酸溶液中溶质的质量为X,
Zn + H2SO4 === ZnSO4 + H2
65 98
6.5g X
![]() 解得:X = 9.8g
解得:X = 9.8g
所以,所用稀硫酸溶液中溶质的质量分数为:
38.(2015·山东枣庄)某同学给自家的蔬菜大棚补施二氧化碳气肥:在棚内悬挂一大塑料桶,装入稀释后的工业硫酸,然后每天(阳光充足)向桶中加入一定量的碳酸氢铵(NH4HCO3),反应后可生成硫酸铵、水和二氧化碳。若一个大棚一天补施二氧化碳气肥330g,请回答:
(1)一个大棚内一天需要碳酸氢铵多少克。(写出计算过程)
(2)当稀硫酸反应完后,塑料桶内剩余的硫酸铵是一种___________(填“复合肥”“氮肥”或“磷肥”)。
【答案】(1)设:需要NH4HCO3的质量为X
2NH4HCO3+H2SO4=(NH4)2SO4+2CO2↑+2H2O
158 88
X 330 g
158/X=88/330 g
解得:X=592.5 g
(2)氮肥
【解析】 (1)本题是利用化学方程式的计算题。已知生成物CO2的质量为330 g,根据方程式中NH4HCO3与CO2的质量比关系,可求出参加反应的NH4HCO3的质量。解答过程如下:
设:需要NH4HCO3的质量为X
2NH4HCO3+H2SO4=(NH4)2SO4+2CO2↑+2H2O
158 88
X 330 g (2分)
158/X=88/330 g
解得:X=592.5 g (2分)
(2)生成物硫酸铵中只含有氮元素一种营养元素,属于氮肥。 (1分)
31. (2015·浙江台州)铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。
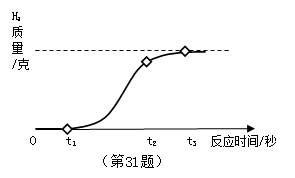 (1)小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显的气泡,原因是 ▲ 。在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是 ▲ 。
(1)小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显的气泡,原因是 ▲ 。在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是 ▲ 。
(2)为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。
【答案】(1)铝在空气中被氧气氧化,生成一层致密的氧化铝保护膜,阻止铝与稀盐酸反应;(2分)
稀盐酸的溶质质量分数在反应中逐渐降低。(2分)
(2)解:生成氢气的质量:1.9克+50克-51.7克=0.2克 ………1分
设生成0.2克氢气,需要参加反应的单质铝的质量为m
2Al+6HCl═2AlCl3+3H2↑
54 6
m 0.2克 ………………………………………1分
![]()
m=1.8克 …………………………………………………………1分
单质铝的质量分数:![]() ……………………1分
……………………1分
答:样品中单质铝的质量分数为94.7%。
【解析】(1)铝在空气中被氧气氧化,生成一层致密的氧化铝保护膜,化学方程式为:4Al+3O2==2Al2O3,阻止铝与稀盐酸反应;由于在反应过程中稀盐酸中的溶质HCl越来越少,所以稀盐酸的溶质质量分数在反应中逐渐降低,t2~t3时间段产生气泡速度放缓。
(2)首先根据质量守恒定律算出反应生成氢气的质量为:1.9克+50克-51.7克=0.2克;然后将氢气的质量0.2克代入化学方程式计算出生成0.2克氢气,需要参加反应的单质铝的质量为1.8克,再进一步求出样品中单质铝的质量分数。
27.(2015•山东潍坊)(8分)铝合金的生产与销售是潍坊市一条重要的产业链。为测定某种铝铜合金中铝的质量分数,探究学习小组进行了如下实验:
|
实验编号 |
铝铜合金的质量(g) |
加入稀硫酸的质量(g) |
生成 H2 的质量(g) |
|
实验3 |
30 |
392 |
2 |
|
实验2 |
30 |
588 |
3 |
|
实验3 |
30 |
600 |
3 |
(1)所用稀硫酸溶质的质量分数为___________________。
(2)该铝合金中铝的质量分数是多少?
【答案】(1)25%(3分) (2)90%
【解析】(1)设392g稀硫酸中H2SO4的质量为y。
2Al+3H2SO4 ====Al2(SO4)3+3H2↑
294 6
y 2g
![]()
![]()
y=98g
所用稀硫酸溶质的质量分数=![]() ×100% = 25%
×100% = 25%
(2)设30g铝铜合金中铝的质量为x。
2Al+3H2SO4 ====Al2(SO4)3+3H2↑ (1分)
54 6
X 3g (1分)
![]()
![]() (1分)
(1分)
x=27g (1分)
铝铜合金中铝的质量分数为:
![]() ×100% = 90% (1分)
×100% = 90% (1分)
答:铝铜合金中铝的质量分数为90%。
18.(2015·福建厦门)(10分)胃酸主要成分是盐酸,正常人胃液每日需要盐酸溶质质量约为6.5g~7.3g。某患者每日分泌盐酸溶质质量为9.0g,为治疗胃酸过多需服用图9所示抑酸剂,发生反应:Mg(OH)2+2HCl=MgCl2+2H2O。请计算并回答:按说明书用法用量,每天最多可中和胃液中盐酸溶质质量是多少克?理论上能否使该患者胃液中盐酸溶质质量恢复到正常范围?(写出计算过程,结果精确到0.001)

【答案】解:设可消耗胃液中盐酸溶质质量为m
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
58 2×36.5
0.145g×2×3 m
![]()
m=1.095g
服药一天后胃液中剩余盐酸溶质质量=9.0g—1.095g=7.905g
7.905g>7.3g,不能恢复到正常范围。
答:按说明书用法用量,每天最多可中和胃液中盐酸溶质质量是1.095g,理论上不能使该患者胃液中盐酸溶质质量恢复到正常范围。
(说明:其他解法参考以上解题过程给分)
【解析】根据说明书用法用量,每天摄入Mg(OH)2的质量为(0.145×2×3)g,利用化学方程计算可求出(0.145×2×3)g所消耗的盐酸溶质的质量。计算过程如下:
解:设可消耗胃液中盐酸溶质质量为m
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
58 2×36.5
0.145g×2×3 m
![]()
m=1.095g
即按照说明书用法用量,每天可中和盐酸溶质的质量为1.095g。
因为每天该病人分泌盐酸溶质质量为9.0g,9.0g-1.095g=7.905g,仍大于正常盐酸溶质质量的上限(7.3g),因此,按照说明书的用法用量,不能使胃酸中的盐酸溶质质量恢复到正常范围。
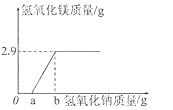 17.(2015•福建漳州)(10分)20g硫酸镁溶液中混有少量硫酸,向该溶液中滴加足量氢氧化钠溶液,充分反应后得到2.9g氢氧化镁沉淀,沉淀的质量变化如右图所示。
17.(2015•福建漳州)(10分)20g硫酸镁溶液中混有少量硫酸,向该溶液中滴加足量氢氧化钠溶液,充分反应后得到2.9g氢氧化镁沉淀,沉淀的质量变化如右图所示。
(1)求20g溶液中硫酸镁的质量分数。
[相关的反应化学方程式为:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4]
(2)氢氧化钠的质量 g时,反应不产生沉淀,其原因是 。
【答案】(1)25%。(2)≤a,氢氧化钠先要中和少量的硫酸,只有硫酸被中和完之后才能生成氢氧化镁沉淀。
【解析】(1)溶液中含有硫酸镁的质量为x。
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
120 58
X 2.9g
120:58=X: 2.9g
解之得,X=6g
所以,溶液中硫酸镁的质量分数为:6g÷20g×100%=30%。
16.(2015•山东东营)( 11 分)在实验室中,化学兴趣小组的同学发现了一瓶敞口放置的 Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验分析:称取试剂 19.8g 放入锥形瓶中,加入 30.2g 的水,充分振荡,再向锥形瓶中依次滴加 25g 盐酸充分反应。测得部分数据与图像如下。请根据
有关信息回答问题。
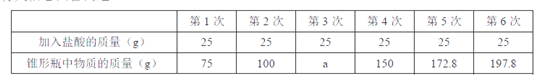
(1)a的数值为 ,兴趣小组的同学通过实验,得出该试剂己部分变质的结论,其依据是(通过实验数据和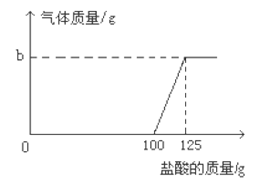
图像做出你的分析) 。
(2)b的数值为 。
计算该试剂中氢氧化钙的质量分数(写出计算过程,结果保留一位小数)。
【答案】(1)125 滴加盐酸至100g时,开始有CO2生成,证明有CaCO3存在:之前滴加盐酸无现象,说明盐酸与Ca(OH)2反应从而证明有Ca(OH)2存在
(2)2.2
解:设参加反应的CaCO3的质量为x
CaCO3+2HCl = CaCl2+ H2O + CO2↑
100 44
x 2.2g
100:44=x:2.2g
x = 5g
故试剂中Ca(OH)2的质量为19.8g-5g=14.8g
Ca(OH)2的质量分数为14.8g/19.8g×100%=74.7%
答:该试剂中氢氧化钙的质量分数为74.7%。
【解析】根据表中的数据可以分析出第三次反应,锥形瓶中的物质完全反应,并且无气体生成,所以a为125;当滴加盐酸至100g时,开始有CO2生成,证明有CaCO3存在;之前滴加盐酸无现象,说明盐酸与Ca(OH)2反应,从而证明有Ca(OH)2存在,所以该试剂己部分变质;生成气体的质量为19.8 g +30.2 g +150 g -197.8 g =2.2g,根据化学方程式和生成二氧化碳气体的质量可以计算出变质后生成碳酸钙的质量,进而计算出氢氧化钙的质量。
解:设参加反应的CaCO3的质量为x
CaCO3+2HCl = CaCl2+ H2O + CO2↑
100 44
x 2.2g
100:44=x:2.2g
x = 5g
故试剂中Ca(OH)2的质量为19.8g-5g=14.8g
Ca(OH)2的质量分数为14.8g/19.8g×100%=74.7%
答:该试剂中氢氧化钙的质量分数为74.7%。
36.(2015·甘肃兰州)现有家庭食用碱样品12g(主要成分Na2CO3,其它成分不与酸反应),加入某未知浓度的盐酸,生成气体的质量与加入盐酸的质量关系如图。请计算:
(1)食用碱中碳酸钠的纯度是多少?
(2)盐酸的溶质的质量分数是多少?(要求写出计算过程,结果精确到0.1)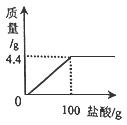
【答案】解:设参加反应的Na2CO3、HCl的质量分别为x、y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
X y 4.4g
![]()
解得
x=10.6g y=7.3g
(1) Na2CO3%= ![]()
(2) HCl%=
答:食用碱中碳酸钠的为88.3%,所有盐酸的溶质质量分数为7.3%。
【解析】(1)由坐标图可知生成的二氧化碳质量为4.4g,通过二氧化碳的质量可以求出碳酸钠的质量,进而求得碳酸钠的质量分数;(2)由二氧化碳的质量也能求出恰好完全反应时100g盐酸溶液中溶质的质量,进而求得盐酸的溶质质量分数。
18.(2015·甘肃武威)某补钙药剂说明书的部分信息如右下图所示。现将用20片该药制剂制成的粉末与40g盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为55.6g。请回答下列问题(计算请写出过程):
(1)青少年缺钙易出现的疾病是 ;
(2)该品牌补钙药剂每片含CaCO3的质量为多少?
(3)该盐酸中溶质的质量分数是多少?(精确到0.1%)
【答案】(1)佝偻病 (1分)
解:设20片该药剂中含CaCO3的质量为x,40g盐酸中含HCl的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y (20g+40g-55.6g) (1分)
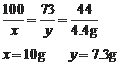 (2分)
(2分)
(2)10g÷20=0.5g (1分)
(3)7.3g÷40g×100%=18.3% (1分)
答:该品牌补钙药剂每片含CaCO3的质量为0.5g,该盐酸中溶质的质量分数为18.3%。
【解析】根据质量守恒定律确定出此反应产生二氧化碳的质量为20g+40g-55.6g=4.4g,据此进行有关化学方程式的计算。
22.(8分)(2015·广东茂名)某氢氧化钙粉末中含有碳酸钙杂质。现取样品15g于锥形瓶中并加适量水搅拌得悬浊液,然后向锥形瓶中滴加稀盐酸,充分反应,测得加入稀盐酸的质量与反应生成气体的质量关系如图所示.
(1)生成二氧化碳的质量是 g;
(2)加入60g稀盐酸后所得溶液中含有的溶质是 、 (填化学式);
(3)计算样品中碳酸钙的质量分数(写出计算过程,结果精确到0.1%).
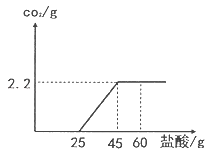
【答案】(1)2.2 (2)CaCl2 HCl (3)设该样品中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 2.2g
![]() x=5g
x=5g
样品中碳酸钙的质量分数为:![]() 33.3%
33.3%
答:样品中碳酸钙的质量分数为33.3%。
【解析】由图可知产生二氧化碳的质量为2.2g,25g的稀盐酸和氢氧化钙发生了化学反应,20g稀盐酸和碳酸钙发生了化学反应,所以加入60g稀盐酸后所得溶液中溶质为CaCl2、HCl;
根据二氧化碳的质量可以求出碳酸钙的质量,便可得出样品中碳酸钙的质量分数。
23.(6分)(2015•湖南岳阳)某学习小组用KClO3和MnO2的混合物加热制取O2,收集到4.8gO2后停止加热,称得剩余固体的质量为28.0g,继续加热至不再产生O2,最终剩余固体质量为23.2g,试计算(不考虑O2的损耗);
(1)两次生成O2的总质量为 g;
(2)理论上可回收到MnO2的质量(写出计算过程)。
【答案】⑴9.6;⑵8.3g。
【解析】⑴两次生成O2的总质量=4.8g+(28.0g-23.2g)=9.6 g
⑵由完全反应生成的氧气的质量,可以求出最终剩余固体中KCl的质量。设最终剩余固体中KCl的质量为x
2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
149 96
x 9.6g
![]()
解得x=14.9g
MnO2的质量为23.2g-14.9g=8.3g。
答:(1)两次生成O2的总质量为9.6 g;(2)理论上可回收到MnO2的质量8.3g。
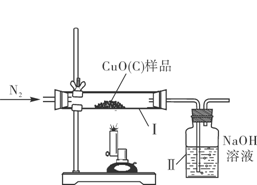 18、(2015·四川雅安)(8分)某种氧化铜样品中混有少量木炭粉,为测定该样品中氧化铜的质量分数,某同学设计了如下装置进行实验(N2不参加反应,不考虑外界空气对实验的影响)。
18、(2015·四川雅安)(8分)某种氧化铜样品中混有少量木炭粉,为测定该样品中氧化铜的质量分数,某同学设计了如下装置进行实验(N2不参加反应,不考虑外界空气对实验的影响)。
(1)该实验需要测定的量:反应前后装置Ⅱ的质量和 的质量
(2)充分反应后,装置Ⅱ的质量增加了0.44 g,求参加反应的氢氧化钠的质量。(请根据化学方程式列式计算)
(3)为达到实验目的,对反应前取用10%的氢氧化钠溶液要求是 g。
【答案】(1)放入Ⅰ中的样品 (2)0.8g (3) ≥8g
【解析】
(1)若要测定样品中氧化铜的质量分数,则需测定反应前样品的质量和氧化铜的质量,由于氧化铜的质量无法直接测定,故可通过测定其与碳反应后生成二氧化碳的质量即装置Ⅱ反应前后的质量差,从而由二氧化碳的质量反过来求得反应的氧化铜的质量,由此可计算;
(2)解:设参加反应的氢氧化钠的质量为x
CO2 + 2NaOH=Na2CO3 + H2O
44 80
0.44 g x
![]()
x=0.8g
答:参加反应的氢氧化钠的质量为0.8g.
(3)为尽可能吸收生成的二氧化碳气体,在反应过程中,所需氢氧化钠的量要大于等于所反应的氢氧化钠的量,故在反应前至少应取10%氢氧化钠的量为:0.8g÷10%=8g,即所取溶液的质量要大于等于8g。
30.(6分)(2015•广西南宁)为测定某纯碱样品(含少量硫酸钠杂质)中碳酸钠的质量分数,某化学兴趣小组进行以下实验.取一定质量的样品放置于烧杯中.向烧杯中滴加一定溶质质量分数的稀盐酸,实验测得烧杯中物质的总质量与加入稀盐酸的质量的关系如图所示.求:
(1)所取样品的质量是 g.
(2)样品中碳酸钠的质量分数是 (精确到0.1%).
(3)所用稀盐酸的溶质质量分数(写出具体的计算过程).
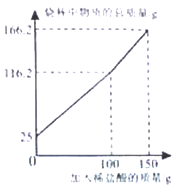
【答案】(1)25 (2)84.8% (3)14.6%
【解析】(1)由图知,在未加盐酸时,烧杯中物质的总质量即所取样品的质量为25g;
(2)由图知,加100g盐酸后烧杯中剩余物质的总质量为116.2g,当加入盐酸质量为150g时,烧杯中剩余物质总质量为166.2g,说明加100g盐酸后烧杯中的碳酸钠已全部反应完全。则生成二氧化碳的质量为:100g+25g-116.2g=8.8g,则设反应的碳酸钠的质量为x,所用盐酸的溶质质量分数为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
x 100y 8.8g
106/x=73/100y=44/8.8g
解得:x=21.2g
y=14.6%
则样品中碳酸钠的质量分数为:21.2g/25g×100%=84.8%
答:所取样品的质量是25g;样品中碳酸钠的质量分数是84.8%,所用稀盐酸的溶质质量分数为14.6%
36. (2015·河北)某同学用锌和稀硫酸制取氢气.向气体发生装置中加入一定量锌粒,将30g稀硫酸分三次加入,每次生产气体的质量如下表.
|
次数 |
第一次 |
第二次 |
第三次 |
|
加入稀硫酸质量/g |
10 |
10 |
10 |
|
生成氢气质量/g |
0.04 |
0.04 |
0.02 |
(1)共制得氢气 g.
(2)所用稀硫酸的溶质质量分数.
【答案】(1)0.1;(2)19.6%
【解析】(1)三次产生氢气的总质量为:0.04g+0.04g +0.02g=0.1g;
(2)解:设10g稀硫酸中溶质的质量为x
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.04g
98:2=x:0.04g
x=1.96g
稀硫酸的溶质质量分数=1.96g/10g×100%=19.6%
答:稀硫酸的溶质质量分数为19.6%
17.(2015•山东威海)测定铁制品中铁的质量分数
铁是常用的金属材料,兴趣小组的同学对某铁制品中的质量分数进行测定.称取3g铁屑,缓慢加入一定溶质质量分数的硫酸溶液,直到过量(假设除铁以外的物质都不与硫酸反应),实验数据如图所示.
请计算:(1)该铁制品中的铁的质量分数.(最终结果保留到0.1%)
(2)所用硫酸溶液的溶质质量分数.(要求有计算的过程)
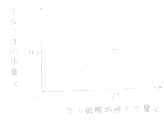
【答案】解:分析图像可知,反应中硫酸过量,铁完全反应生成的氢气质量为:0.2g。
设:反应的铁的质量为x,反应的稀硫酸中硫酸的质量为y
Fe+H2SO4=FeSO4+H2↑
56 98 2
x y 0.1g 列比例式:56/x=98/y=2/0.1g;解得:x=2.8g,y=4.9g。
(1)铁制品中铁的质量分数为:(2.8g/3g)×100%=93.3%;
(2)所用稀硫酸中溶质的质量分数为:(4.9g/25g)×100%=19.6%。
答:(1)铁制品中铁的质量分数为:93.3%;(2)所用稀硫酸中溶质的质量分数为:19.6%。
【解析】此题考查化学计算知识。解:分析图像可知,反应中硫酸过量,铁完全反应生成的氢气质量为:0.2g。
设:反应的铁的质量为x,反应的稀硫酸中硫酸的质量为y
Fe+H2SO4=FeSO4+H2↑
56 98 2
x y 0.1g 列比例式:56/x=98/y=2/0.1g;解得:x=2.8g,y=4.9g。
(1)铁制品中铁的质量分数为:(2.8g/3g)×100%=93.3%;
(2)所用稀硫酸中溶质的质量分数为:(4.9g/25g)×100%=19.6%。
答:(1)铁制品中铁的质量分数为:93.3%;(2)所用稀硫酸中溶质的质量分数为:19.6%。
17、(4分)(2015•新疆乌鲁木齐)某化学兴趣小组同学在实验室里,利用旧电池的外壳锌皮制取氢气.在200g的稀硫酸中加入足量的锌皮,完全反应后,制得了0.2g氢气,试计算,该稀硫酸的溶质质量分数是多少?
【答案】4.9%
【解析】解:设生成0.2g氢气需要硫酸的质量为x
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.2g
![]() x=9.8g
x=9.8g
稀硫酸的智联分数为:9.8g/200g×100%=4.9%
答:该稀硫酸的溶质质量分数为4.9%。
33.(2015·湖北咸宁)某纯碱样品中含有少量氯化钠,取该样品11g,全部溶液在100g水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,A点时,过滤,得到滤液242g,计算:
(1)反应生成沉淀的质量m为 g。
(2)滤液中溶质的质量分数。
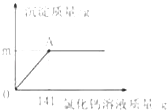
【答案】⑴10;⑵5%。
【解析】反应生成的沉淀的质量m=11g+100g+141g-242g=10g。
设生成的NaCl质量为x,原样品中Na2CO3的质量为y。
CaCl2+ Na2CO3=2NaCl +CaCO3↓
106 117 100
y x 10g
![]()
解得x=11.7g y=10.6g
则滤液中溶质质量分数为![]() =5%
=5%
答:反应生成的沉淀的质量为10g,滤液中溶质质量分数为5%。
23.(2015·陕西)某化学兴趣小组同学为回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,烧杯内剩余固体质量为27g。
请完成下列分析及计算:
(1)40g铜锌合金中锌的质量是 g。
(2)计算所用稀硫酸中溶质的质量分数。
【答案】

【解析】(1)由于反应过程中铜锌合金中的铜与稀硫酸不反应而锌能与稀硫酸反应,所以最后烧杯内剩余固体为27g铜;
(2)由于参加反应的锌的质量为40g-27g=13g,所以可以算出参加反应的100g稀硫酸中溶质的质量,再进一步求出所用稀硫酸中溶质的质量分数。
35.(2015•浙江丽水)资料一:原煤中含有硫,燃烧时生成的SO2会污染空气;
资料二:测量SO2含量的反应原理为SO2+2H2O+I2=H2SO4+2HI;
资料三:加了生石灰的原煤燃烧时可减少SO2排放,反应原理为2CaO+2SO2+O2高温 2CaSO4。
请回答:
(1)原煤燃烧产生的SO2在雨、雪降落过程中会形成 ▲ ,它能腐蚀建筑物、使土壤酸化等;
(2)取用原煤燃烧产生的工业废气样品1米3,缓缓通过含碘(I2)1.27毫克的碘溶液,刚好完全反应。则该工业废气中SO2的含量为 ▲ 毫克/米3(假设工业废气中的其它物质不与碘反应);
(3)若该工业废气中含有128克SO2,要除去这些SO2,理论上需在产生该工业废气的原煤中加入含氧化钙80%的生石灰多少克(假设工业废气中的其它物质不与氧化钙反应)?
【答案】(1)酸性降水(2)0.32;(3)解:设需要氧化钙的质量为x
2CaO + 2SO2 + O2高温 2CaSO4
112 128
x 128克
112∶128=x∶128克;解得x=112克
生石灰的质量为:112克/80%=140克。
【解析】此题考查化学计算知识。(1)二氧化硫会造成酸雨,故是酸性降水(2)根据反应的化学方程式:SO2+2H2O+I2=H2SO4+2HI;可求出二氧化硫的含量是:0.32;(3)解:设需要氧化钙的质量为x
2CaO + 2SO2 + O2高温 2CaSO4
112 128
x 128克
112∶128=x∶128克;解得x=112克
生石灰的质量为:112克/80%=140克。
28. (2015·山东莱芜)(7分)侯氏制碱法的主要反应为:NH3 + CO2 + H2O+ NaCl =NaHCO3+NH4Cl。一定温度下,向92.6g饱和NaCl溶液中先通人足量NH3,再通人一定量CO2发生反应,若参加反应的NH3质量为3.4g,请计算:(写出计算步骤,不考虑溶解在溶液中的NH3和CO2的质量)
⑴消耗CO2的质量是多少?
(2)反应后称量溶液中析出NaHCO3晶体的质量为11.8 g,则剩余溶液的质量是多少?
(3)求剩余溶液中NaHCO3的质量分数 (计算结果精确到0.1%)。
【答案】解:设3.4g NH3反应,需要二氧化碳的质量为x, 生成碳酸氢钠的质量为y
NH3 + CO2 + H2O+ NaCl =NaHCO3+NH4Cl
17 44 84
3.4g x y
![]()
解得x=8.8g y=16.8 g
(2)析出碳酸氢钠固体后剩余溶液的质量为:92.6g+3.4g+8.8g-11.8g=93.0g
(3)溶液中剩余碳酸氢钠的质量为:16.8 g-11.8g=5.0g
![]() =5.4%
=5.4%
【解析】已知参加反应的一种反应物的质量,可以求出参加反应的其它物质的质量和反应生成的各物质的质量。根据化学方程式,列出已知条件和需要求的物质的质量(用未知数表示)。剩余溶液的质量,等于原溶液的质量加上加入的各物质的质量,减去从溶液中析出的固体的质量;剩余溶液中溶质碳酸氢钠的质量要减去已经从溶液中析出的质量。
33.(2015·黑龙江龙东)(7分)将4g含有可溶性杂质的硫酸铜样品溶于足量水,再向所得溶液中逐滴加入75g一定溶质质量分数的氯化钡溶液(杂质不与氯化钡溶液反应)。实验过程中,生成沉淀的质量与滴入氯化钡溶液的质量关系如图所示。试计算:
(1)恰好完全反应时,生成沉淀的质量是 g。
 (2)样品中硫酸铜的质量分数是多少?
(2)样品中硫酸铜的质量分数是多少?
(3)反应后的溶液中,氯化钡的质量是多少?
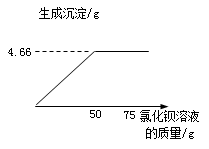
【答案】(1)4.66(1分)(2)解:设硫酸铜质量为x,参加反应的氯化钡质量的为y,反应后溶液中氯化钡质量为z
CuSO4+BaCl2=BaSO4↓+CuCl2
160 208 233
x y 4.66g
![]() x=3.2g
x=3.2g
![]() y=4.16g
y=4.16g
样品中硫酸铜的质量分数为![]()
(3) ![]() ,z=2.08g
,z=2.08g
(或![]() )
)
答:样品中硫酸铜的质量分数为80%,反应后的溶液中,氯化钡的质量为2.08g.。
25.(2015•广东汕尾)取盐酸与氯化铜的混合溶液27g放入烧杯中,逐滴滴入质量分数为20%的NaOH溶液,产生沉淀质量与滴入NaOH溶液质量的关系如图所示.
(1)滴入NaOH溶液的质量在0~4g时,发生反应的化学方程式为 ;
(2)与氯化铜反应的NaOH的质量为 g;
(3)原盐酸与氯化铜的混合溶液中氯化铜的质量分数(写出计算过程).
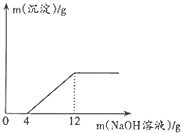
【答案】 ⑴NaOH+HCl=NaCl+H2O ⑵ 1.6g ⑶10%
【解析】 ⑴盐酸和氢氧化钠反应生成氯化钠和水,氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠。
由反应图像可知,0——4g发生的是盐酸和氢氧化钠的反应
⑵和氯化铜反应的氢氧化钠为:20g×20%= 1.6g
⑶设混合液中氯化铜的质量为x
2NaOH+CuCl2==Cu(OH)2↓+2NaCl
80 135
1.6g x
80 : 1.6g =135:x
x=2.7g
混合液中氯化铜的质量分数为:2.7g÷27g×100%=10%
答:混合液中氯化铜的质量分数为10%。
19.(5分)(2015•新疆)某化学研究小组为了测定一工厂废水中琉酸的溶质质量分数.取100克废水置于烧杯中,加人100克一定质量分数的硝酸钡溶液恰好完全反应(废水中其它成分不与硝酸钡反应).反应后过滤,将得到的沉淀洗涤、干燥、称重,称得质量为2.33克.(化学反应方程式为Ba(NO3)2+H2S04=BaSO4↓+2HNO3)请计算:
(1)完全反应后烧杯内剩余的溶液质量为 克.
(2)100克废水中硫酸的溶质质量分数是多少?
【答案】(1)197.67克
(2)解:设废水中硫酸的质量为x
Ba(NO3)2+H2SO4=BaSO4+2HNO3
98 233
x 2.33克
=
x=0.98克
废水中硫酸的溶质质量分数为:×100%=0.98%
答:略。
【解析】(1)根据质量守恒定律反应后,剩余溶液的质量=100g+100g-2.33g=197.67g;根据反应生成硫酸钡的沉淀的质量及硝酸钡与硫酸反应的化学方程式可以计算出100g废液中硫酸的质量,然后再根据溶质的质量分数=溶质质量/溶液质量×100%即可计算出来。
27.(6分)(2015•贵州铜仁)贵州铜仁地处武陵山区,石灰石资源丰富,某课外小组同学取该样品12.0g于烧杯中,向盛有样品的烧杯中加入足量一定溶质质量分数的稀盐酸溶液充分反应,所用稀盐酸质量(用X表示)和烧杯中剩余固体质量(用Y表示)如图所示(石灰石的主要成分是碳酸钙,杂质不溶于水也不与酸反应),请回答下列问题:
(1)石灰石中碳酸钙的质量是多少?
(2)充分反应后共生成多少二氧化碳?
(3)所用稀盐酸的溶质质量分数是多少?
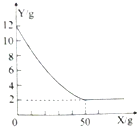
【答案】(1)根据图可得碳酸钙的质量为12g-2g=10g
(2)设生成二氧化碳的质量为x,反应消耗的稀盐酸溶质质量为y
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 73 44
10g y x
解得:x=![]() ,y=
,y=![]()
(3)所用稀盐酸的溶质质量分数为![]()
答:石灰石中碳酸钙的质量为10g;充分反应后共生成二氧化碳4.4g;所用稀盐酸的溶质质量分数是14.6%.
【解析】根据所给图像信息可知,反应前固体为12g,反应后变为2g为不溶物质量,由此可知碳酸钙的质量为12g-2g=10g,利用碳酸钙的质量分别计算出生成二氧化碳和参加反应的盐酸中溶质的质量从而得出答案。
专题四、计算应用题
一、选择题
28.(2015•辽宁本溪)50g硝酸钙溶液与56g碳酸钾溶液混合后,恰好完全反应,过滤得到硝酸钾的不饱和溶液101g,反应的化学方程式为Ca(NO3)2+K2CO3═CaCO3↓+2KNO3.
(1)生成碳酸钙沉淀的质量为 g.
(2)计算反应后硝酸钾的不饱和溶液中溶质的质量分数.
【答案】⑴5g ⑵10%
【解析】 ⑴碳酸钙的质量=50g+56g-101g=5g
⑵由碳酸钙可以计算生成的硝酸钾的质量
设反应后生成硝酸钾的质量为x
K2CO3 + Ca(NO3)2===CaCO3↓ + 2KNO3
100 202
5g x
100 / 5g =202/ x x=10.1g
所得溶液中硝酸钾的质量分数为:10.1g÷101g×100%=10%
答:(1)5g;(2)反应后硝酸钾的不饱和溶液中溶质的质量分数10%。
15.(2015·黑龙江哈尔滨)实验室有碳酸钾和碳酸钙的固体混合物75g,使之与500g质量分数为14.6%的盐酸充分反应,将反应后的溶液蒸干得到82.7g固体。则原混合物中金属元素的质量分数为( )
A.44% B.46% C.50% D.55%
【答案】A
【解析】根据题意可知碳酸钾和碳酸钙的质量为75g,得到氯化钙和氯化钾的质量为82.7g,通过化学方程式的计算可以求出原混合物中金属元素的约质量为33g,即可解答。
15. (2015·天津) 下列说法正确的是
A. 等质量的CO和CO2,CO和CO2中氧元素的质量比为11:14
B. 等质量的Al和Mg分别与足量稀硫酸充分反应,生成H2的质量相等
C. 等质量的NaHCO3和MgCO3分别与足量稀盐酸充分反应,生成CO2的质量相等
D. 等质量的质量分数均为4%氢氧化钠溶液与稀盐酸充分反应,所得溶液显中性
【答案】 AC
【解析】 A.本选项采用公倍数法计算。CO、CO2的相对分子质量分别为28、44,则(28×44)为两者的一个公倍数,假设这个公倍数即为CO、CO2的质量,则CO中氧元素质量为(28×44)×![]() =44×16,CO2中氧元素质量为(28×44)×
=44×16,CO2中氧元素质量为(28×44)×![]() =28×32,两者中氧元素质量比为(44×16):(28×32)=11:14,A正确。
=28×32,两者中氧元素质量比为(44×16):(28×32)=11:14,A正确。
B.根据两种金属与酸反应的化学方程式:2Al+6HCl=2AlCl3+3H2↑、Mg+2HCl=MgCl2+H2↑,结合酸足量,可得出如下关系式:
2Al——3H2 Mg——H2
54 6 24 2
由关系式可知,当酸足量时,金属质量与产生氢气质量比,铝为54:6=9:1,镁为24:2=12:1,即若金属质量相等,则铝产生氢气质量比镁多,B错误。
C. 因为盐酸足量,故产生二氧化碳的质量与反应物的质量、相对分子质量有关,因为反应物质量相等、相对分子质量也相等(都是84),故可知产生的二氧化碳质量也相等,C正确。
D.根据化学方程式NaOH+HCl=NaCl+H2O,若反应后溶液呈中性,则NaOH与HCl的质量比为80:73,因而等质量、等浓度的两种溶液充分反应后,盐酸有剩余,所得溶液显酸性,D错误。
20.(2015·湖南株洲)已知:X和Y两种物质共80g ,在一定条件下恰好完全反应,生成Z与W的质量比为11︰9,且反应中消耗X的质量是生成W的质量的4/9,则反应中消耗Y的质量为
A.16g B.36g C.44g D.64g
【答案】D
【解析】X + Y = Z + W
(80-a)×16 a 44 36
解得a=64g
17.(2015·湖北宜昌)某同学为了测定铜镁合金样品中铜的质量分数,将100g稀盐酸分2次加入到盛有5g该样品的烧杯中,所得数据如下表,则下列说法中错误的是
|
次数 |
实验前 |
第1次 |
第2次 |
|
加入稀盐酸的质量/g |
0 |
50 |
50 |
|
剩余固体的质量/g |
5 |
3 |
2 |
A.第1次加入稀盐酸后剩余固体中还有镁 B.第2次所加入的稀盐酸未反应完
C.每50g稀盐酸和1g镁恰好完全反应 D.合金样品中铜的质量分数为40%
【答案】C
【解析】分析题给信息可知,加入第1次稀盐酸50g后剩余了2g固体,反应了3g镁,第2次加入50g稀盐酸后剩余固体为2g,只反应了1g镁,说明剩余固体2g都是铜,即合金样品中铜的质量分数为2g/5g=40%,D正确;第1次加入稀盐酸后剩余固体中还有1g镁,A正确;第2次所加入的稀盐酸未反应完,只与1g镁反应,B正确;每50g稀盐酸和2g镁恰好完全反应,而不是1g镁,C错误。
二、填空、简答题
三、实验探究题
四、分析与计算
14(2015·贵州黔西南)如图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
(1)欲配制溶质质量分数为5%的稀盐酸溶液200g,需要溶质质量分数为37%的浓盐酸多少毫升?(计算结果保留小数点后一位)
(2)化学综合实践活动小组的同学,对一造纸厂排放的污水进行检测,发现其主要的污染物是氢氧化钠,为了测定污水中氢氧化钠的含量,他们量取80g污水于烧杯中,逐滴加入溶质质量分数5%的稀盐酸至73g时恰好完全反应(污水中的其他成分不与盐酸饭)。求污水中氢氧化钠的质量分数。

【答案】(8分)(1)设需要质量分数为37%的浓盐酸的体积为x
200g×5%=x×1.18g.cm-3×37%
x=22.9cm3=22.9mL
(2)设污水中氢氧化钠的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 73g×5%
![]()
x=4g
则污水中氢氧化钠的质量分数为![]() 。
。
答:污水中氢氧化钠的质量分数为5%.
【解析】(1)由于配制5%的稀盐酸需要浓盐酸,因此在溶液稀释过程中溶质的质量不变,所以设需要质量分数为37%的浓盐酸的体积为x,则200g×5%=x×1.18g.cm-3×37%,解得x=22.9cm3=22.9mL。(2)按照化学方程式进行计算,注意参加反应的稀盐酸中溶质质量为73g×5%带入方程式进行计算。
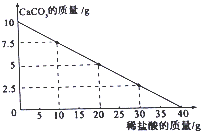 25.(2015·山东滨州)向10g CaCO3中不断加入稀盐酸,其质量变化如图所示,请回答下列问题:
25.(2015·山东滨州)向10g CaCO3中不断加入稀盐酸,其质量变化如图所示,请回答下列问题:
(1)当10gCaCO3恰好完全反应时,所加稀盐酸的质量为 g。
(2)所加稀盐酸的溶质质量分数为多少?(写出计算过程,结果精确到0.01%)
【答案】(1)40;(2)解:设第四次加入盐酸后反应的氯化氢的质量为x
第四次加入盐酸后,反应的碳酸钙的质量为10g
CaCO3+2HCl=CaCl2+CO2+H2O
100 73
10g x 列比例式得:73/x=100/10g;解得:x=7.3g
则反应的盐酸中溶质的质量分数为:(7.3g/40g)×100%=18.25%。
【解析】此题结合图表综合考查了化学计算和化学生活知识。(1)根据图表分析,其中加入40g稀盐酸时,10g碳酸钙恰好完全反应
;(2)解:设第四次加入盐酸后反应的氯化氢的质量为x
第四次加入盐酸后,反应的碳酸钙的质量为10g
CaCO3+2HCl=CaCl2+CO2+H2O
100 73
10g x 列比例式得:73/x=100/10g;解得:x=7.3g
则反应的盐酸中溶质的质量分数为:(7.3g/40g)×100%=18.25%。
35.(2015·黑龙江哈尔滨)为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:
(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是______;
(2)发生反应的化学方程式为____________________________________________;
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(x)的比例式为__________;
(4)该黄铜样品中铜的质量分数是__________;
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是__________;(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是__________,再经过某些反应及操作就得到了所需铜盐。
【答案】(1) 40 g(l分) (2) Zn+ 2HCl=ZnC12+ H2↑(1分)
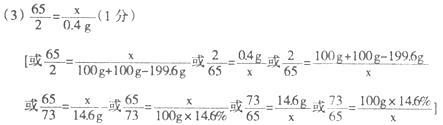
(4)80%(1分)(5)13.6%(1分)(6)107 g(l分)
【解析】分析图示可知产生氢气的质量为0.4g,根据化学方程式可以求出锌的质量,以及反应后所得溶液的溶质质量分数,根据混合物的质量100g,含杂质7%,知道锌的质量,可以求出铜的质量分数,根据铜的质量可以求出氧化铜的质量,从而求出含杂质的氧化铜的质量。解:(1)设需要36.5%的盐酸的质量为x
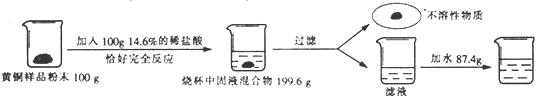
100×14.6%=x×36.5% x=40g
(2)产生氢气的质量为:100g+100g-199.6g=0.4g
设该样品中锌的质量为y,生成硫酸锌的质量为z
Zn+ 2HCl=ZnC12+ H2↑
65 136 2
Y z 0.4g
![]() y=13g
y=13g
![]() z=27.2g
z=27.2g
该样品中铜的质量分数为:![]() ×100%=80%
×100%=80%
最后所得溶液的溶质质量分数为:![]() ×100%=13.6%
×100%=13.6%
样品中铜的质量为:100g-100g×7%-13g=80g
所以氧化铜的质量为:80g÷![]() =100g,含杂质的氧化铜的质量为100g+100g×7%=107g
=100g,含杂质的氧化铜的质量为100g+100g×7%=107g
32.(2015·湖南株洲)(6分)华雪同学想测定某Cu-Ag合金中两种金属的质量比。称取这种合金9.6g,加入足量AgNO3溶液充分反应后过滤,将所得固体洗涤、干燥后称量,质量为24.8g。
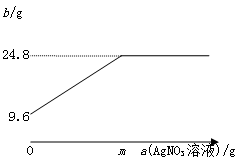 (1)发生反应的化学方程式为
。
(1)发生反应的化学方程式为
。
(2)试计算该合金中铜与银的质量比。(请写出计算过程)
(3)华雪同学认为还可算出该AgNO3溶液中溶质的质量分数,于是进行了多次实验,记录了每次使用AgNO3溶液的质量a(AgNO3溶液)和充分反应后所得固体的质量b,并绘制了右图,则AgNO3溶液中溶质的质量分数是多少?(请写出计算过程,用含m的代数式表示)
【答案】(1) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag(2分)
(2)解:设9.6g Cu-Ag合金中Cu的质量为x ,则Cu-Ag合金中Ag的质量为9.6 g - x,反应生成的Ag的质量为24.8g – (9.6 g -x) = 15.2g + x
Cu+ 2AgNO3 = Cu(NO<, sub>3)2 + 2Ag
64 2×108
x 15.2g + x
64∶216 = x∶(15.2g + x) 得:x=6.4g
m(Ag) = 9.6g - 6.4g =3.2g
m(Cu)∶m(Ag) = 6.4g∶3.2g = 2∶1 (2分)
答:该合金中铜与银的质量比为 2∶1。
(3)设m g AgNO3溶液中含AgNO3的质量为y,则有:
Cu+ 2AgNO3 = Cu(NO3)2 + 2Ag
64 2×170
6.4 y
64∶340= 6.4∶y 得:y =34g
硝酸银溶液中溶质的质量分数 =![]() ×100%
(2分)
×100%
(2分)
答:硝酸银溶液中溶质的质量分数为![]() ×100%。
×100%。
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1

