| 上传:邓菘化学 | 审核发布:admin | 更新时间:2016-1-19 9:49:47 | 点击次数:499次 |
质量守恒定律
(2015年)
一、选择题
1.(2015•郴州)化学方程式![]() 中X 的化学式为
中X 的化学式为
A. NaOH B.![]() C. NaH D.
C. NaH D.![]()
解:由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2Na2O2+2H2O=4X+O2↑,反应前钠、氧、氢原子个数分别为4、6、4,反应后的生成物中钠、氧、氢原子个数分别为0、2、0,根据反应前后原子种类、数目不变,则4X分子中含有4个钠原子、4个氢原子和4个氧原子,则每个X分子由1个钠原子、1个氢原子和1个氧原子构成,则物质X的化学式为NaOH.
故选:A
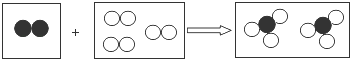
2.(2015•衡阳)“三效催化转换器”可将汽车尾气中的有害气体转化为无毒气体,其中某个反应的微观示意图如图.从图示获得的下列信息错误的是( )
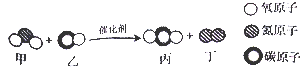
A. 该图示能反映质量守恒定律
B. 反应前后共有四种分子
C. 甲和丁中同种元素的化合价不同
D. 乙和丙中所含原子种类相同
考点: 微粒观点及模型图的应用;有关元素化合价的计算;质量守恒定律及其应用..
专题: 化学反应模拟图型.
分析: 观察反应的微观示意图,根据微粒的变化分析该图示能否反映质量守恒定律;根据微粒的构成分析分子、原子的种类物质的类别等.
解答: 解:A、由图示可知,该图示中反应前后原子的数目不同,不能反映质量守恒定律,故A错误;
B、由微粒的构成可知,反应前后共有四种分子,故B正确;
C、由微粒的构成可知,甲为二氧化氮,丁为氮气,同种元素为氮元素,化合价分别+4、0,同种元素的化合价不同,故C正确;
D、由微粒的构成可知,乙和丙中都含有碳原子和氧原子,原子种类相同,故D正确.
故选A.
点评: 本题属于微观示意图的考查,解题的关键是能够熟练分析微观粒子表示的物质的特征:构成相同的分子为同种物质的分子,由同种原子构成的分子为单质的分子,由不同种原子构成的分子为化合物的分子,只有掌握这些才能顺利解题.
3.(2015•衡阳)把一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是( )
|
物 质 |
a |
b |
c |
d |
|
反应前的质量(g) |
6.4 |
3.2 |
4.0 |
2.8 |
|
反应后的质量(g) |
5.2 |
X |
7.2 |
2.8 |
A. a和c是反应物 B. d一定是催化剂
C. X=2.0 D. 该反应是化合反应
考点: 质量守恒定律及其应用;催化剂的特点与催化作用;反应类型的判定..
专题: 化学用语和质量守恒定律.
分析: 根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.反应后质量增加的是生成物,减少的是反应物,由表格信息可知反应后c质量增加了7.2g﹣4g=3.2克,是生成物;a质量减少了6.4g﹣5.2g=1.2克,是反应物;d质量不变,做催化剂或者是杂质.反应物还少2克,所以b是反应物,所以反应后物质b的质量为3.2g﹣2g=1.2g,反应物是a和b,生成物是c,反应符合“多变一”的特点,从而可以解答.
解答: 解:A、由表格信息和分析可知反应物是a和b;故A错误;
B、d质量不变,做催化剂或者是杂质,故B错误;
C、b是反应物,反应后物质b的质量为3.2g﹣2g=1.2g,故C错误;
D、由分析可知反应物是a和b,生成物是c,反应符合“多变一”的特点,为化合反应,故D正确;
故选D.
点评: 解此题需认真分析各物质的质量变化情况,依据质量守恒定律仔细推敲,即可求解.根据质量守恒定律认真分析各物质反应前后的质量变化情况解答此类题的关键.
4.(2015•怀化)铜与稀硝酸反应可产生一种气体X,方程式为3Cu+8HNO3═3Cu(NO3)2+2X↑+4H2O,则X的化学式是()
A. H2O B. NO C. Cu D. N2
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
解答: 解:由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式3Cu+8HNO3═3Cu(NO3)2+2X↑+4H2O,反应前铜、氢、氮、氧原子个数分别为3、8、8、24,反应后的生成物中铜、氢、氮、氧原子个数分别为3、8、6、22,根据反应前后原子种类、数目不变,则2X分子中含有2个氮原子和2个氧原子,则每个X分子由1个氮原子和1个氧原子构成,则物质X的化学式为NO.
故选:B.
点评: 本题难度不大,利用化学反应前后原子守恒来确定物质的化学式是正确解答此类题的关键.
5.(2015•邵阳)黑火药的主要成分是硝酸钾、木炭粉、硫磺粉等,点燃时发生爆炸的化学方程式为:2KNO3+S+3C![]() K2S+3CO2↑+X↑,其中X的化学式是( )
K2S+3CO2↑+X↑,其中X的化学式是( )
A. N2 B. NO2 C. NO D. N2O
考点: 质量守恒定律及其应用..
专题: 化学用语和质量守恒定律.
分析: 根据化学方程式为2KNO3+S+3C![]() K2S+3CO2↑+X↑,利用质量守恒定律来分析解答;
K2S+3CO2↑+X↑,利用质量守恒定律来分析解答;
解答: 解:由化学方程式为2KNO3+S+3C![]() K2S+3CO2↑+X↑,
K2S+3CO2↑+X↑,
根据质量守恒定律可知,反应前后元素种类、原子个数相等,
K、O、C、S的原子个数前后相等,
而反应物中有N元素,生成物中应一定有N元素,
则X中只含有N元素,
反应前共2个N原子,则x中共2个N原子
又X的化学计量数为1,则X的化学式为N2,
故选A
点评: 本题考查利用化学方程式来确定某物质的化学式,学生应能根据质量守恒定律中的元素守恒、原子守恒来确定物质的化学式,注意守恒思想在解题中的重要应用.
6.(2015•永州)如图是某化学反应前后的微观反应示意图,下列说法不正确的是( )
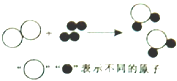
A. 化学反应前后分子数目发生了改变
B. 生成物可能是氧化物
C. 反应前后元素的种类没有改变
D. 反应物中有一种单质和一种化合物
考点: 微粒观点及模型图的应用;从组成上识别氧化物;单质和化合物的判别;化学反应的实质..
专题: 化学反应模拟图型.
分析: 观察化学反应前后的微观反应示意图,根据微粒的变化分析分子、原子、元素的变化等;根据微粒的构成分析物质的类别等.
解答: 解:A、由微粒的变化可知,反应前后原子的种类、数目都不变.故A正确;
B、由微粒的构成可知,生成物的分子是由两种原子构成的,若一种原子是氧原子,就是氧化物,故B正确;
C、由微粒的变化可知,反应前后原子的种类不变,元素的种类也不变,故C正确;
D、由微粒的构成可知,两种反应物的分子都是有同种的原子构成的,都属于单质,故D错误.
故选D.
点评: 本题通过微观粒子的反应模型图,考查了微观上对化学反应的认识,学会通过微观示意图把宏观物质和微观粒子联系起来、从微观的角度分析物质的变化是正确解答此类题的关键.
7.(2015•岳阳)使用催化净化装置,可降低汽车尾气中CO和NO的排放,其反应原理为2NO+2CO![]() □+2CO2,则□内应填( )
□+2CO2,则□内应填( )
A. N B. N2 C. 2N D. 2N2
考点: 质量守恒定律及其应用..
专题: 化学用语和质量守恒定律.
分析: 由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断□内生成物的化学式.
解答: 解:由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2NO+2CO![]() □+2CO2,反应前氮、氧、碳原子个数分别为2、4、2,反应后的生成物中氮、氧、碳原子个数分别为0、4、2,根据反应前后原子种类、数目不变,则每个□分子由2个氮原子构成,则□内物质的化学式为N2.
□+2CO2,反应前氮、氧、碳原子个数分别为2、4、2,反应后的生成物中氮、氧、碳原子个数分别为0、4、2,根据反应前后原子种类、数目不变,则每个□分子由2个氮原子构成,则□内物质的化学式为N2.
故选:B.
点评: 本题难度不大,利用化学反应前后原子守恒来确定物质的化学式是正确解答此类题的关键.
8.(2015•张家界)汽车安装使用催化净化装置是减少汽车尾气对空气污染的有效方法之一.其主要发生催化剂的化学反应方程式为:2NO+2CO![]() 2CO2+N2下列对该化学反应的说法不正确的是( )
2CO2+N2下列对该化学反应的说法不正确的是( )
A. 反应物都属于氧化物
B. 该反应使有害气体转化为无害物质
C. 反应前后元素的种类、原子和分子个数都不变
D. 化学反应方程式中所表示的反应物和生成物中只有一种物质是单质
考点: 化学方程式的概念、读法和含义;从组成上识别氧化物;单质和化合物的判别;化学反应的实质.
专题: 化学用语和质量守恒定律.
分析: A、根据氧化物的定义分析;
B、该反应使有害气体转化为无害物质;
C、反应前后分子个数改变;
D、反应物和生成物中只有氮气是单质.
解答: 解:A、NO和CO都是由氧元素和和另一元素组成的氧化物,故正确;
B、该反应使有害气体转化为无害物质,正确;
C、反应前后分子个数改变,故错误;
D、反应物和生成物中只有氮气是单质,故正确;
故选C.
点评: 掌握氧化物的概念:只有两种元素组成,其中一种为氧元素;学会利用质量守恒定律的元素守恒处理问题.
9.(2015•张家界)质量守恒定律是帮助我们认识化学反应实质的重要理论.某物质R与水和氧气反应的化学方程式为:2R+2H2O+7O2═2FeSO4+2H2SO4则R的化学式应为( )
A. FeS B. Fe2S3 C. FeO D. FeS2
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 由质量守恒定律:反应前后,原子种类、数目均不变,据此再由反应的化学方程式推断反应物R的化学式.
解答: 解:根据反应的化学方程式2R+2H2O+7O2═2FeSO4+2H2SO4,反应物中氢、氧原子个数分别为4、16,反应后的生成物中氢、硫、氧、铁原子个数分别为4、4、16、2,根据反应前后原子种类、数目不变,则2R中含有2个铁原子和4个硫原子,则每个R分子由1个铁原子和2个硫原子构成,则物质X的化学式为FeS2.
故答案为:D.
点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.
10.(2015•株洲)如图表示两种物质发生的化学反应,其中相同的球代表同种原子,小球间的短线代表原子间的结合.下列说法中不正确的是( )
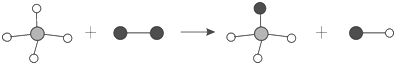
A. 图示有4种分子 B. 图示反应前后原子个数不变
C. 图示发生了复分解反应 D. 图示产物为混合物
考点: 分子、原子、离子、元素与物质之间的关系;纯净物和混合物的判别;反应类型的判定..
专题: 化学反应模拟图型.
分析: A、观察微粒的微观构成,判断分子的种类;
B、根据反应前后原子的种类、数目分析;
C、根据复分解反应的生成物的特点分析;
D、根据微粒的构成,分析物质种类.
解答: 解:A、由微观模型示意图可知,图示中共有4种不同的分子构成,有4种分子.故A正确;
, , B、对比反应前后,原子的种类、数目不变,符合质量守恒定律.故B正确;
C、由该反应的生成物的微观模型示意图可知,反应物为一种化合物一种单质,生成物为两种化合物;复分解反应的反应物、生成物都是化合物.所以,该反应不属于复分解反应.故不正确;
D、由微粒的变化可知.生成物中有两种化合物,是混合物.故D正确.
故选C.
点评: 分子由原子构成,构成不同的分子属于不同种物质的分子,由同种原子构成的分子属于单质分子,由不同种原子构成的分子属于化合物的分子.
11.(2015•株洲)已知:X和Y两种物质共80g,在一定条件下恰好完全反应,生成Z与W的质量比为11:9,且反应中消耗X的质量是生成W的质量的,则反应中消耗Y的质量为( )
A. 16g B. 36g C. 44g D. 64g
考点: 质量守恒定律及其应用..
专题: 化学用语和质量守恒定律.
分析: 根据质量守恒定律可知参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,即参加反应的X和Y的质量和跟生成Z和W的质量和相等.
解答: 解:由质量守恒定律,X和Y两种物质共80g,则生成Z和W共80g,而Z、W两物质完全反应时的质量比为11:9,故反应生成W的质量是:80g×![]() =36g,反应中消耗X的质量是:36g×4/9=16g,则反应中消耗Y的质量为:80g﹣16g=64g.
=36g,反应中消耗X的质量是:36g×4/9=16g,则反应中消耗Y的质量为:80g﹣16g=64g.
故选D.
点评: 本题主要考查质量守恒定律中的物质总质量不变的特点,难度较小.
二、非选择题
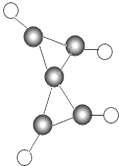
1.(2015•益阳)科学家最近在低温下合成了一种化合物,其分子模型如图所示,其中“![]() ”代表碳原子,“
”代表碳原子,“![]() ”代表氢原子.
”代表氢原子.
请补充该物质燃烧的化学方程式:
C5H4 +6O2![]() 5CO2+ 2H2O .
5CO2+ 2H2O .
考点: 书写化学方程式、文字表达式、电离方程式..
专题: 化学用语和质量守恒定律.
分析: 由题意,由一种化合物的分子模型图,1个该化合物的分子是由5个碳原子和4个氢原子构成的,则该化合物的化学式为C5H4;燃烧生成二氧化碳和水,写出反应的化学方程式即可.
解答: 解:由一种化合物的分子模型图,1个该化合物的分子是由5个碳原子和4个氢原子构成的,则该化合物的化学式为C5H4;燃烧生成二氧化碳和水,反应的化学方程式为C5H4+6O2![]() 5CO2+2H2O.
5CO2+2H2O.
故答案为:C5H4;2H2O.
点评: 本题难度不大,考查化学方程式的书写方法,由化合物的分子模型确定该化合物的化学式是正确解答本题的关键.
(2014年)
1.(2014•常德)实验室可用高锰酸钾与浓盐酸反应制取氯气,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+8X+5Cl2↑,其中X的化学式为( )
A. H2O B. H2O2 C. HClO D. O2
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 化学反应前后,元素的种类不变,原子的种类、总个数不变.
解答: 解:2KMnO4+16HCl(浓)═2KCl+2MnCl2+8X+5Cl2↑可知,
反应前钾原子是2个,反应后是2个;
反应前锰原子是2个,反应后是2个;
反应前氧原子是8个,反应后应该是8个,包含在8X中;
反应前氢原子是16个,反应后应该是16个,包含在8X中;
反应前氯原子是16个,反应后是16个;
由分析可知,每个X中含有2个氢原子和1个氧原子,是水,水的化学式是H2O.
故选:A.
点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.
2.(2014•常德)一定条件下某密闭容器内发生了化学反应,反应前后各物质的质量变化如下表所示
|
物 质 |
A |
B |
C |
D |
|
反应前的质量(克) |
17 |
64 |
2 |
0 |
|
反应后的质量(克) |
m |
0 |
46 |
36 |
下列说法错误的是( )
A. m=1 B. 反应生成的C与D 的质量比为11:9
C. 该反应一定属于复分解反应 D. 该反应可表示为:A+B→C+D
考点: 质量守恒定律及其应用;反应类型的判定.
专题: 化学用语和质量守恒定律.
分析: 反应后B的质量减少了64g,是反应物;
反应后C的质量增加了44g,是生成物;
反应后D的质量增加了36g,是生成物;
根据质量守恒定律可知,A是反应物,参加反应的质量为:44g+36g﹣64g=16g.
解答: 解:A、m=17﹣16=1,该选项说法正确;
B、反应生成的C与D的质量比为:44g:36g=11:9,该选项说法正确;
C、虽然反应物和生成物都是两种,但是不知道反应物和生成物的所属类别,因此该反应不一定属于复分解反应,该选项说法错误;
D、该反应可表示为:A+B→C+D,该选项说法正确.
故选:C.
点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.
3.(2014•郴州)在一密闭容器内发生某反应,反应过程中各物质的质量变化如下表,其中未知数据正确的是( )
|
物质 |
a |
b |
c |
d |
|
反应前 |
60g |
60g |
0 |
0 |
|
反应中 |
36g |
12g |
18g |
① |
|
反应后 |
② |
0 |
③ |
④ |
A. ①为30g B. ②为20g C. ③为22.5g D. ④为77.5g
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 本题可分析四种物质反应前后的质量变化情况,确定是反应物还是生成物,然后根据质量守恒定律确定d是反应物还是生成物,结合质量守恒定律进行分析解答即可.
解答: 解:由表中数据分析可知,反应前后b的质量减少了60g﹣0g=60g,故b是反应物,参加反应的b的质量为60g.
A、由质量守恒定律,反应后①的质量为(60g﹣36g)+(60g﹣12g)﹣(18g﹣0g)=54g,故选项说法错误.
B、由反应前与反应中ab的质量关系,参加反应的ab的质量比为(60g﹣36g):(60g﹣12g)=1:2;完全反应后参加反应的b的质量为60g,则完全反应时参加反应的a的质量为30g;则②为60g﹣30g=30g,故选项说法错误.
C、由反应前与反应中bc的质量关系,参加反应的b与生成的c的质量比为(60g﹣12g):(18g﹣0g)=8:3,则完全反应后生成的c的质量为60g×![]() =22.5g,则③为22.5g,故选项说法正确.
=22.5g,则③为22.5g,故选项说法正确.
D、完全反应后生成d的质量为30g+60g﹣22.5g=67.5g,故选项说法错误.
故选:C.
点评: 本题难度不大,考查的是质量守恒定律的应用,解题的关键是分析表中数据,灵活运用质量守恒定律.
4.(2014•衡阳)在一定条件下发生反应:2R+2H2O+7O2═2FeSO4+2H2SO4,则R的化学式是( )
A. FeS B. Fe2S3 C. FeO D. FeS2
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 由题意知反应的化学方程式为2R+2H2O+7O2═2FeSO4+2H2SO4,根据质量守恒定律:①宏观意义:反应物和生成物的总质量不变;元素种类、质量不变;②微观意义:原子种类不变;原子数目不变; 原子质量不变;故可推测R的化学式.
解答: 解:根据质量守恒定律:①宏观意义:反应物和生成物的总质量不变;元素种类、质量不变;②微观意义:原子种类不变;原子数目不变; 原子质量不变;可知“2R”中含有4个硫原子、2个亚铁离子,故其化学式为FeS2.
故选D.
点评: 掌握有关化学式的计算和推断方法;掌握质量守恒定律的内容及其应用.
5.(2014•衡阳)如图是两种物质反应的微观示意图,从示意图中获取的下列信息不正确的是( )
A. 该反应涉及的物质中共有三种元素 B. 该反应属于置换反应
C. 反应前后原子数目发生改变 D. 化学反应是原子重新组合的过程
考点: 微粒观点及模型图的应用;化学反应的实质;反应类型的判定.
专题: 化学反应模拟图型.
分析: A、根据原子的种类分析元素的种类;
B、根据反应的特点分析反应的类型;
C、根据微粒变化分析原子的变化;
D、根据微粒的变化分析化学反应的实质.
解答: 解:A、反应前的两种分子中共含有三种原子,反应后生成的两种物质的分子中也含有这三种原子;根据元素为同种原子的总称,可判断该反应中涉及三种元素.故A正确;
B、通过反应的图示可知,反应物和生成物都是一种单质和一种化合物,属于置换反应.故B正确;
C、由反应的微观示意图可知,反应前有4个原子,反应后有4个原子,反应前后原子数目发生没有改变.故C不正确;
D、由反应微观图可知,生成物的分子是由反应物分子中原子重新结合而构成的,即该反应是两种分子的原子重新组合的过程;故D正确.
故选C.
点评: 解答本题的关键是要充分理解图中提供的信息,充分理解“一种小球代表一种原子”,根据微粒的变化会分析分子、原子的变化等.只有这样才能对问题做出正确的判断.
6.(2014•衡阳)4.6g某化合物在足量氧气中充分燃烧,生成8.8g二氧化碳和5.4g水.下列对该化合物组成的判断中,正确的是( )
A. 由碳、氢两种元素组成,
B. 由碳、氧两种元素组成
C. 由碳、氢、氧两种元素组成
D. 一定含有碳、氢两种元素,可能含有氧元素
考点: 质量守恒定律及其应用;化合物中某元素的质量计算.
专题: 化学用语和质量守恒定律.
分析: 化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和.
解答: 解:根据质量守恒定律,参加反应的氧气质量为:8.8g+5.4g﹣4.6g=9.6g;
8.8g二氧化碳中氧元素的质量为:8.8g×![]() ×100%=6.4g,
×100%=6.4g,
5.4g水中氧元素的质量为:5.4g×![]() ×100%=4.8g,
×100%=4.8g,
该化合物中氧元素的质量为:6.4g+4.8g﹣9.6g=1.6g,
二氧化碳中的碳元素和水中的氢元素来自于该化合物,因此该化合物中含有碳元素、氢元素和氧元素.
故选:C.
点评: 化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式的基础.
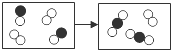
7.(2014•娄底)如图是某化学反应的微观模型,“![]() ”、“
”、“![]() ”分别表示不同元素的原子.下列对图示模型理解正确的是( )
”分别表示不同元素的原子.下列对图示模型理解正确的是( )
A. 反应前后分子的种类发生了改变
B. 反应物和生成物中只有一种单质
C. 反应前后原子的种类与数目发生了改变
D. 参加反应的两种物质分子个数之比为1:2
考点: 微粒观点及模型图的应用;单质和化合物的判别..
专题: 化学反应模拟图型.
分析: A、根据微粒的变化分析分子的变化;
B、根据物质的微观构成,分析物质的类别;
C、根据微粒的变化分析原子的变化;
D、根据化学反应的微观模型和质量守恒定律分析参加反应的两种物质分子个数之比.
解答: 解:A、由微粒的变化可知,反应前后分子的种类发生了改变.故A正确;
B、单质的分子由一种原子构成,化合物的分子由多种原子构成,由图示可知看出反应物是两种单质,而生成物是一种化合物.故B错误;
C、由微粒的变化可知,反应前后原子的种类与数目没有发生改变.故C错误;
D、由反应的图示结合质量守恒定律可知,参加反应的两种物质分子个数之比为1:3.故D错误.
故选A.
点评: 该题关键是从模型图中看出各物质分子的构成,注意解题是要考虑到模型图中每种分子有几个参加反应,利用反应时的微粒个数关系及结构可很轻松的判断.
8.(2014•娄底)在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如下:
|
四种物质 |
甲 |
乙 |
丙 |
丁 |
|
反应前质量(g) |
25 |
15 |
1 |
5 |
|
反应后质量(g) |
11 |
未测 |
1 |
22 |
则下列表述正确的是( )
A. 未测值为2 B. 丙可能是催化剂
C. 乙全部发生了反应 D. 甲与乙反应的质量比为25:15
考点: 质量守恒定律及其应用;催化剂的特点与催化作用..
专题: 化学用语和质量守恒定律.
分析: 利用质量守恒定律,反应前后各物质的质量总和相等,可计算出反应后未测的乙物质的质量;根据反应前后各物质的质量关系,对反应中各物质参与反应情况进行判断.
解答: 解:
A、根据质量守恒定律,未测物质乙的质量=(25+15+1+5)g﹣(11+1+22)g=12g;故A不正确;
B、物质丙在反应前后质量不变,根据催化剂在反应前后质量和化学性质不变的特点,可推测该物质可能为反应的催化剂;故B正确;
C、反应后乙物质的质量为12g,根据反应前后物质质量差可得知反应中只有15g﹣12g=3g乙物质发生了反应;故C不正确;
D、参加反应的甲、乙物质的质量比=(25g﹣11g):(15g﹣12g)=14:3;故D错误;
故选:B.
点评: 对此类问题进行分析时,根据质量守恒定律计算出表中未测物质的质量,是需要首先解决的量.
9.(2014•邵阳)两种气体发生化学反应的微观示意图如下,其中相同的球代表同种原子,下列说法正确的是( )
![]()
A. 该反应是置换反应 B. 生成物一定是氧化物
C. 化学反应前后分子的种类不变 D. 化学反应前后原子的种类不变
考点: 微粒观点及模型图的应用;从组成上识别氧化物;反应类型的判定.
专题: 化学反应模拟图型.
分析: 根据化学反应的微观示意图,对比反应前后微粒的变化,分析分子、原子的变化;分析生成物的组成;分析反应的特点,判断反应的类型.
解答: 解:A、由化学反应的微观示意图可知,该反应由两种物质生成了一种物质,属于化合反应.故A说法不正确;
B、由生成物的微观构成可知,反应后生成了一种新的化合物,但不一定其中一种元素是氧元素,不能说明是氧化物.故B说法不正确;
C、由反应前后微粒的变化可知,分子在化学变化中发生了变化,说明了分子的种类发生了变化.故C说法不正确;
D、由反应前后微粒的变化可知,化学反应前后原子的种类和数量都不变.故D说法正确.
故选D.
点评: 本题通过微观粒子的反应模型图,考查了微观上对化学反应的认识,学会通过微观示意图把宏观物质和微观粒子联系起来、从微观的角度分析物质的变化是正确解答此类题的关键.
10.(2014•湘潭)如图是某化学反应的微观示意图,从图中获得的信息错误的是( )
A. 该图表示的是一个化合反应
B. 该图表示反应物和生成物都有两种
C. 原子是化学变化中的最小粒子
D. 化学反应中,反应物、生成物的微粒个数比可表示为2:1:2
考点: 微粒观点及模型图的应用;反应类型的判定.
专题: 化学反应模拟图型.
分析: 根据化学反应的微观模拟示意图,把反应后剩余的分子与反应前抵消,可得到该反应为一种单质的分子和一种化合物的分子通过分成的原子的再重新组合而形成一种化合物的分子,据此分析解答即可.
解答: 解:可得实际参加反应的微观示意图为,
A、根据化学反应的微观模拟示意图,得到该反应为一种单质的分子和一种化合物的分子通过分成的原子的再重新组合而形成一种化合物的分子,
故为化合反应;故A正确;
B、根据化学反应的微观模拟示意图,得到该反应为一种单质的分子和一种化合物的分子通过分成的原子的再重新组合而形成一种化合物的分子,故B错误;
C、由图示可知反应前后原子种类没有变化,故C正确;
分子是由原子构成的,故C正确;
D、从图示可知化学反应中,反应物、生成物的微粒个数比可表示为2:1:2;故D正确.
故选B.
点评: 能根据提供的图形信息作出准确的判断,能分清分子的原子构成和反应特点,是解决此类题目的关键.
11.(2014•湘潭)某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表.根据表中信息,判断下列说法正确的是( )
|
物质 |
X |
O2 |
CO2 |
H2O |
|
反应前质量/g |
23 |
70 |
1 |
0 |
|
反应后质量/g |
0 |
待测 |
45 |
27 |
A. 该反应为分解反应
B. 反应生成的CO2和H2O的质量比为45:27
C. 表中“待测”值为21
D. X中含有氧元素
考点: 质量守恒定律及其应用;反应类型的判定.
专题: 化学用语和质量守恒定律.
分析: 反应后X的质量减少了23g,是反应物;
反应后二氧化碳质量增加了44g,是生成物;
反应后水的质量增加了27g,是生成物;
根据质量守恒定律可知氧气是反应物,参加反应的氧气质量为:44g+27g﹣23g=48g.
解答: 解:A、反应物和生成物都是两种,不属于分解反应,该选项说法不正确;
B、反应生成的CO2和H2O的质量比为:44g:27g=44:27,该选项说法不正确;
C、表中“待测”值为:70g﹣48g=22g,该选项说法不正确;
D、X中氧元素的质量为:44g×![]() ×100%+27g×
×100%+27g×![]() ×100%﹣48g=8g,因此X中含有氧元素,该选项说法正确.
×100%﹣48g=8g,因此X中含有氧元素,该选项说法正确.
故选:D.
点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.
12.(2014•益阳)某物质X与O2发生反应的化学方程式是:X+3O2![]() 2CO2+2H2O.下列说法中错误的是( )
2CO2+2H2O.下列说法中错误的是( )
A. X的化学式为C2H4 B. X具有可燃性
C. 该反应为置换反应 D. X是一种有机物
考点: 质量守恒定律及其应用;有机物与无机物的区别;反应类型的判定.
专题: 化学用语和质量守恒定律.
分析: A、由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.
B、由反应条件是点燃进行分析判断.
C、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应.
D、含有碳元素的化合物叫有机化合物,简称有机物.
解答: 解:A、根据反应的化学方程式X+3O2![]() 2CO2+2H2O,反应物中氧S原子个数为6,反应后的生成物中碳、氧、硫原子个数分别为2、6、4,根据反应前后原子种类、数目不变,则每个X分子由2个碳原子和4个氢原子构成,则物质X的化学式为C2H4,故选项说法正确.
2CO2+2H2O,反应物中氧S原子个数为6,反应后的生成物中碳、氧、硫原子个数分别为2、6、4,根据反应前后原子种类、数目不变,则每个X分子由2个碳原子和4个氢原子构成,则物质X的化学式为C2H4,故选项说法正确.
B、该反应的反应条件是点燃,可知X具有可燃性,故选项说法正确.
C、该反应的生成物均为化合物,不属于置换反应,故选项说法错误.
D、X是含碳元素的化合物,属于有机物,故选项说法正确.
故选:C.
点评: 本题难度不大,掌握利用化学反应前后元原子守恒来确定物质的化学式的方法、置换反应与有机物的特征等是正确解题的关键.
13.(2014•永州)如图是电解水的微观示意图,从中获得的信息错误的是( )
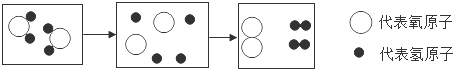
A. 化学变化中,分子可分为原子,原子不能再分
B. 反应前后分子的种类和数目没有改变
C. 生成的氢分子与氧分子的分子个数比为2:1
D. 一个氧分子由2个氧原子构成
考点: 微粒观点及模型图的应用;化学反应的实质.
专题: 化学反应模拟图型.
分析: 根据图示提供的信息进行分析.在水分解过程中,水分子发生了改变,生成了氢分子和氧分子.化学反应前后原子的种类没有改变.水分解后生成氢气和氧气的分子数比为2:1,以及物质的分类分析解答即可.
解答: 解:根据图示可知,水分解的方程式为:2H2O![]() 2H2↑+O2↑,据此对选项进行分析:
2H2↑+O2↑,据此对选项进行分析:
A、从该反应的图示可知在该反应中水分子能分解生成氢、氧两种原子,而氢、氧两种原子没有再分,从而可知化学反应中,分子分为原子,原子不能再分.故A正确;
B、由电解水的微观示意图,在通电的条件下,每两个水分子变化成了两个氢分子和一个氧分子,反应前后分子的种类和数目发生了改变.故B错误;
C、由方程式可以看出,该反应生成的氢气与氧氧气的分子个数比是2:1.故C正确;
D、由氧分子的微观构成可知,一个氧分子由2个氧原子构.故D正确.
故选B.
点评: 解答本题的关键是要充分理解图中提供的信息方面的知识,并书写相关的方程式,然后对相关选项进行分析判断即可.
14.(2014•永州)在一密闭容器中,有甲、乙、丙、四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
|
物质 |
甲 |
乙 |
丙 |
丁 |
|
反应前的质量(g) |
24.5 |
5 |
0.1 |
0.4 |
|
反应后的质量(g) |
0 |
5 |
15 |
x |
下列说法正确的是( )
A. 乙是反应物 B. 丁是催化剂
C. 该反应为化合反应 D. X=10
考点: 质量守恒定律及其应用;催化剂的特点与催化作用;反应类型的判定.
专题: 化学用语和质量守恒定律.
分析: 根据化学反应前后质量减少的是反应物,质量增加的是生成物,由表格的数据结合质量守恒定律可以完成反应物和生成物的判断,进而结合基本反应类型的特点来完成解答即可.
解答: 解:
由表格的数据结合质量守恒定律,可知:24.5g+5g+0.1g+0.4g=5g+15g+x,则x=10g,物质质量减少的为反应物,故甲为反应物,而质量增加的丙、丁为生成物;即反应物为一种,而生成物为两种,符合“一变多”的特点,故属于分解反应.
A、乙的质量不变,可能为催化剂,可能没有参与反应;
B、丁的质量由0.4g,变为10g,不可能是催化剂;
C、由分析可知:反应物为一种,而生成物为两种,符合“一变多”的特点,故属于分解反应;
D、由分析可知:由表格的数据结合质量守恒定律,可知:24.5g+5g+0.1g+0.4g=5g+15g+x,则x=10g.
故选:D.
点评: 此题是结合质量守恒定律和化合反应的特征来判断反应类型,解此题的关键是要会正确分析判断那些物质是反应物,那些物质是生成物.
15.(2014•张家界)小汽车在发生剧烈碰撞时,安全气囊会瞬间弹出,在0.01秒内引发下列化学反应:2NaN3+NH4NO3═3X↑+2Na+N2O↑+2H2O,则X的化学式为( )
A. NO2 B. NO C. N2 D. NaOH
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 化学反应前后,元素的种类不变,原子的种类、总个数不变.
解答: 解:反应前钠原子的个数是2个,反应后是2个;
反应前氮原子的个数是8个,反应后应该是8个,其中6个包含在3X中;
反应前氢原子的个数是4个,反应后是4个;
反应前氧原子的个数是3个,反应后是3个;
由分析可知,每个X中含有2个氮原子,是氮气,化学式是N2.
故选:C.
点评:化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.
16.(2014•张家界)如图是两种气体发生化学反应的微观示意图,其中相同大小的球代表同种原子.下列说法正确的是( )

A. 生成物有两种 B. 分子在化学变化中不可再分
C. 化学反应前后原子的种类不变 D. 化学反应前后分子的种类不变
考点: 微粒观点及模型图的应用;化学反应的实质.
专题: 化学反应模拟图型.
分析: 根据化学反应的微观示意图,对比反应前后微粒的变化,分析分子、原子的变化;分析生成物的种类;分析反应的特点.
解答: 解:
A、由生成物的微观构成可知,反应后生成了一种新的化合物.故A说法不正确;
B、由反应前后微粒的变化可知,分子在化学变化中发生了变化,说明了分子在化学变化中可以分割.故B说法不正确;
C、由反应前后微粒的变化可知,化学反应前后原子的种类和数量不变.故C说法正确;
D、由化学反应的微观示意图可知,该反应由两种物质生成了一种物质,化学反应前后分子的种类发生改变,故D说法不正确.
答案:C
点评: 模型能直观地表示了变化的微观过程;试题通过给出微粒的模型,考查学生的观察能力和对基本概念的理解与运用能力.
17.(2014•株洲)在光照或点燃条件下,氢气和氯气发生反应生成氯化氢,其反应的微观示意图如图所示.下列说法正确的是( )
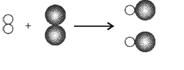
A. 所有化学反应在反应前后分子个数都不发生变化
B. 此反应过程中只有物质变化,没有能量变化
C. 在任何条件下,H2和Cl2均不能大量共存
D. 由微观示意图可知:2gH2和71g Cl2发生反应可生成73g HCl
考点: 微粒观点及模型图的应用;物质发生化学变化时的能量变化.
专题: 化学反应模拟图型.
分析: 根据微观模型结合反应的化学方程式进行分析解答即可.
解答: 解:据图可以看出,该反应是H2+Cl2![]() 2HCl
2HCl
2 71
A、反应前后分子的数目都是2,没有改变,但所有化学反应在反应前后分子个数有时变化,有时不变;故A错误;
B、此反应过程中氢气在氯气中燃烧会放出热量,故B错误;
没有能量变化反应前氢气和氯气均是单质,氢元素和氯元素的化合价是0,反应后氯化氢中氢元素是+1,氯元素是﹣1,化合价均改变,;
C、氢气和氯气发生反应生成氯化氢,是需要在光照或点燃条件下发生的,故C错误;
D、反应中氢气和氯气的质量比是2:71,故D正确;
故选D.
点评: 本题考查了化学反应的微观模型表示,完成此题,可以依据微观模型结合已有的知识进行.
18.(2014•株洲)某物质W在空气中完全燃烧后的产物只有二氧化碳和水.根据以上信息,下列关于物质W组成的说法中正确的是( )
A. 含有C、H、O三种元素 B. 只含C、H元素
C. 含有C、H元素,可能含有O元素 D. 含有C元素,可能含有H、O元素
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 根据质量守恒定律,反应前后元素种类不变,结合题意进行分析解答.
解答: 解:某物质W在空气中完全燃烧后的产物只有二氧化碳和水,氧气是由氧元素组成的;CO2和H2O中含有碳、氧、氢、三种元素,根据质量守恒定律,反应前后,元素种类不变,则W再一定含有碳元素和氢元素,可能含有氧元素.
故选:C.
点评: 本题难度不大,掌握质量守恒定律(反应前后,元素种类不变)并能灵活运用是正确解答本题的关键.
19.(2014•株洲)已知:某密闭容器中,12gA加热完全分解产生B和C,其中B的质量为2g,同时C又能部分分解产生0.1gD和7.9gE,则最终该密闭容器中B和C的质量比为( )
A. 1:1 B. 1:2 C. 1:4 D. 1:5
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 由题意可知,A的质量等于生成的B和C的质量之和,生成的D和E的质量之和等于反应掉的C的质量,然后分析计算进行解答.
解答: 解:因为参加反应的A的质量等于生成的B和C的质量之和,参加反应的A的质量为12g,生成B的质量为2g,则同时生成C的质量为10g,C又部分分解为0.1gD和7.9gE,则反应掉的C的质量为0.1g+7.9g=8g,还剩余C的质量为10g﹣8g=2g.则最终该密闭容器内B的质量为2g,C的质量为2g,质量比为:1:1.
故选A.
点评: 本考点考查了质量守恒定律的应用和有关的计算,有关质量守恒定律的考题在中考中经常出现,还要注意有关的计算要准确,本考点经常出现在选择题和实验题中.
20.(2014•张家界)今年3月30日凌晨,一网民悄悄将百度百科上的PX词条的毒性释义由“低毒”改成“剧毒”,这两个字的改变引发了一场“词条保卫点”.PX的中文名称是对二甲苯(化学式为C8H10).从组成上看对二甲苯属于 化合物 ,它在氧气中完全燃烧的产物是 二氧化碳和水 .
考点: 单质和化合物的判别;质量守恒定律及其应用.
专题: 化学用语和质量守恒定律;物质的分类.
分析: 根据物质的组成和质量守恒定律来分析;二甲苯的化学式为C8H10,由两种元素组成,是化合物,根据质量守恒定律,其燃烧生成二氧化碳和水.
解答: 解:二甲苯的化学式为C8H10,可知其由碳、氢两种元素组成,属化合物;根据质量守恒定律,其燃烧生成二氧化碳和水.
故答案为:化合物;二氧化碳和水;
点评: 根据物质的化学式可以表示物质的组成与构成,利用化学式和质量守恒定律可判断物质燃烧后的产物,属于基础知识的考查.
21.(2014•益阳)氢气在氯气中燃烧生成氯化氢,反应的微观过程如图所示:
(1)写出该反应的化学方程式 H2+Cl2![]() 2HCl
2HCl

(2)通过分析该反应的反应物,请你提出对燃烧条件的新认识 燃烧不一定有氧气参加 .
考点: 微粒观点及模型图的应用;书写化学方程式、文字表达式、电离方程式;燃烧与燃烧的条件.
专题: 化学反应模拟图型.
分析: (1)根据微观结构示意图可写出方程式;
(2)根据燃烧的反应物考虑解答;
解答: 解;(1)根据微观结构示意图可知氢气在氯气中燃烧的反应物是氢气和氯气,生成物是氯化氢,所以方程式是:H2+Cl2![]() 2HCl;
2HCl;
(2)由该方程式可知燃烧不一定有氧气参加;
答案:(1)H2+Cl2![]() 2HCl;
2HCl;
(2)燃烧不一定有氧气参加.
点评: 本题考查了化学反应的微观模型表示和燃烧条件,完成此题,可以依据微观模型结合已有的知识进行.
22.(2014•湘潭)质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题.
(1)化学反应前后肯定没有变化的是 B (填字母序号)
A.①④⑥B.①③⑤⑥C.①②⑥D.②③⑤
①原子数目 ②分子数目 ③元素种类 ④物质种类
⑤原子种类 ⑥物质的总质量
(2)镁条在空气中完全燃烧后生成氧化镁(只考虑氧气参加反应,下同),化学方程式为 2Mg+O2![]() 2MgO ,若固体质量变化用图1表示,则m2与m1之差表示 参加反应的氧气 的质量.
2MgO ,若固体质量变化用图1表示,则m2与m1之差表示 参加反应的氧气 的质量.
(3)实验过程中,镁条点燃后实验现象如图2所示,镁条完全燃烧后,称量得知石棉网上留下固体质量反而比反应前镁条还轻,其原因可能是 部分生成物散逸到空气中 .

考点: 质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
专题: 化学用语和质量守恒定律.
分析: (1)化学反应前后,元素的种类不变,原子的种类、总个数不变;
(2)镁和氧气反应生成氧化镁;
(3)根据实验现象可以判断相关方面的问题.
解答: 解:(1)反应前后原子数目不变,元素种类不变,原子种类不变,物质的总质量不变;
反应前后分子数目可能改变,也可能不变,物质种类一定改变.
故填:B.
(2)镁燃烧的化学方程式为:2Mg+O2![]() 2MgO;
2MgO;
若固体质量变化用图1表示,则m2与m1之差表示参加反应的氧气的质量.
故填:2Mg+O2![]() 2MgO;参加反应的氧气.
2MgO;参加反应的氧气.
(3)通过观察可知,镁燃烧时,一部分生成的氧化镁扩散到了空气中,会导致石棉网上留下固体质量反而比反应前镁条还轻.
故填:部分生成物散逸到空气中.
点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.
23.(2014•邵阳)“嫦娥三号”于2013年12月2日,在西昌卫星发射中心发射,中国成为世界上第3个实现月球软着陆的国家.试回答:
(1)运载“嫦娥三号”的火箭外壳用到了钛合金,钛合金属于 混合物 (填“混合物”或“纯净物”).
(2)发射“嫦娥三号”的火箭所用燃料是偏二甲肼(C2H8N2),推进剂是四氧化二氮(N2O4),两者反应的化学方程式是:C2H8N2+2N2O4═3N2+2CO2+4X,则X的化学式是 H2O .
(3)探月的目的之一是获取新能源﹣﹣氦.一个氦原子的原子核内有2个质子, 1个中子,则核外有 2 个电子.
(4)月球富含钛铁矿,主要成分是钛酸亚铁(FeTiO3),其中钛(Ti)的化合价是 +4 .

考点: 纯净物和混合物的判别;原子的有关数量计算;有关元素化合价的计算;质量守恒定律及其应用.
专题: 化学式的计算;物质的微观构成与物质的宏观组成;化学用语和质量守恒定律;物质的分类.
分析: (1)根据合金的概念进行分析;
(2)根据质量守恒定律的微观解释:化学反应前后,各原子的种类和数目不变;
(3)根据原子中核内质子数=核外电子数分析;
(4)根据在化合物中正负化合价代数和为零,进行解答.
解答: 解:(1)钛合金的主要成分是钛,属于混合物,故填:混合物;
(2)根据质量守恒定律,化学反应前后,各原子的种类和数目不变.从化学方程式C2H8N2+2N2O4=2CO2+4X+3N2看,在化学反应前后(除X外),其它各原子个数差分别是:碳原子2﹣2=0,氢原子8﹣0=8,氮原子2+2×2﹣6=0,氧原子2×4﹣2×2=4,所以4X中共含有8个氢原子,4个氧原子.因此每个X中含有2个氢原子和1个氧原子,即X的化学式为H2O.
故填:H2O;
(3)一个氦原子的原子核内有2个质子,根据原子中核内质子数=核外电子数可知,核外有2个电子,故填:2;
(4)根据在化合物中正负化合价代数和为零,铁元素显+2,氧元素显﹣2,设钛元素的化合价是x,可知钛酸亚铁[FeTiO3]中钛元素的化合价:(+2)+x+(﹣2)×3=0,则x=+4.故填:+4.
点评: 本题难度不大,考查了物质分类的知识、质量守恒定律以及学生利用化合价的原则计算指定元素的化合价的能力.
(2013年)
1.(2013•衡阳)在反应A+3B=2C+3D中,已知A和B的相对分子质量之比为7:8,当2.8gA与一定量B恰好完全反应后,生成3.6gD,则C的质量为( )
A. 6.8g B. 9.6g C. 8.8g D. 4.4g
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 根据“反应A+3B=2C+3D中,已知A和B的相对分子质量之比为7:8”,则可假设A和B的相对分子质量分别为7a、8a,又因为2.8gA与一定量B恰好完全反应,则可求一定量B的质量;根据质量守恒定律的质量守恒,可求C的质量.
解答: 解:根据“反应A+3B=2C+3D中,已知A和B的相对分子质量之比为7:8”,则可假设A和B的相对分子质量分别为7a、8a,又因为2.8gA与一定量B恰好完全反应,则![]() ,则B=9.6克;根据质量守恒定律:2.8+9.6=C+3.6,故C=8.8克.
,则B=9.6克;根据质量守恒定律:2.8+9.6=C+3.6,故C=8.8克.
故选C.
点评: 根据质量守恒定律指参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和;学会利用质量守恒定律处理问题的方法.
2.(2013•常德)化学反应前后肯定没有发生变化的是
①原子数目 ②原子种类 ③分子数目 ④分子种类
⑤元素的种类 ⑥物质的总质量 ⑦物质的种类
A.①②⑤⑥ B.①②③⑤ C.①②⑤⑦ D. ③④⑥⑦
3.(2013•常德)实验室制取氯气(Cl2)时可用氢氧化钠溶液吸收尾气,其化学原理是:
Cl2+ 2NaOH = X + NaClO + H2O,则X的化学式为
A.NaCl B.H2 C.HCl D.HClO
4.(2013•娄底)在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
|
物质 |
甲 |
乙 |
丙 |
丁 |
|
反应前的质量/g |
30 |
55 |
20 |
70 |
|
反应后的质量/g |
0 |
100 |
X |
5 |
根据质量守恒定律判断,X的值为( )
A. 50 B. 70 C. 40 D. 15
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 由题意可知,根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,则可求X值.
解答: 解:由题意可知,根据质量守恒定律,反应前各物质的质量总和=反应后生成各物质的质量总和,则可列式:30+55+20+70=0+100+X+5,解得X=70;
故选B.
点评: 根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.
5.(2013•娄底)如图表示两种气体发生化学反应的微观示意图,其中相同的球代表同种原子.你认为下列说法正确的是( )
![]()
A. 生成物一定是混合物
B. 分子在化学变化中不可分
C. 该反应属于化合反应
D. 化学反应前后元素的种类发生了变化
考点: 微粒观点及模型图的应用;纯净物和混合物的判别;反应类型的判定.
专题: 化学反应模拟图型.
分析: 根据化学反应的微观示意图,对比反应前后微粒的变化,分析分子、原子的变化;分析生成物的种类;分析反应的特点,判断反应的类型等.
解答: 解:A、由生成物的微观构成可知,反应后生成了一种新的化合物.故A说法不正确;
B、由反应前后微粒的变化可知,分子在化学变化中发生了变化,说明了分子在化学变化中可以再分.故B说法不正确;
C、由化学反应的微观示意图可知,该反应由两种物质生成了一种物质,属于化合反应.故C说法正确;
D、由反应前后微粒的变化可知,化学反应前后原子的种类和数量不变,元素的种类没有发生变化.故D说法不正确.
故选C.
点评: 模型能直观地表示了变化的微观过程;试题通过给出微粒的模型,考查学生的观察能力和对基本概念的理解与运用能力.
6.(2013•怀化)化学反应前后,一定没有变化的是( D )
A.物质的种类 B.物质的状态 C.分子的种类和数目 D.原子的种类和数目
7.(2013•怀化)某反应的微观示意图如下(一种小球代表一种元素的原子),则下列说法中正确的是( C )
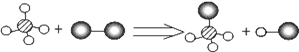
A.参加反应的元素有四种
B.反应物和生成物都属于化合物
C.该示意图说明分子在化学变化中可以分成原子,原子再结合成新的分子
D.该反应属于复分解反应
8.(2013•怀化)我国已经立法,规定酒驾入刑。“酒精检测仪”可检查司机是否酒后驾车,其反应原理为 C2H5OH + 4CrO3 + 6 H2SO4 =2Cr2(SO4)3 + 2CO2↑ + 9X ,司机如有饮酒,红色的CrO3就会变成绿色的Cr2(SO4)3 ,则X的化学式为(B )
A. Na2O B. H2O C. H2SO4 D. CO2
9.(2013•邵阳)据报道,科学家发明了一种“月球制氧机”,这种“月球制氧机”利用聚焦太阳能产生的高温加热月球土壤,制得氧气.据此可推测月球土壤中一定含有( )
A. 氧元素 B. 氧气 C. 氧化物 D. 水
考点: 分子、原子、离子、元素与物质之间的关系.
专题: 物质的微观构成与物质的宏观组成.
分析: 根据氧气的组成和质量守恒定律判断,氧气是由氧元素组成的,由质量守恒定律,反应前后元素的种类不变,要制氧气原料中必须含有氧元素.
解答: 解:A、氧气是由氧元素组成的,根据质量守恒定律,反应前后元素的种类不变,制氧气的原料中必须含有氧元素,故选项正确.
B、制氧气可以用物理方法,也可以用化学方法,如用化学方法的话,原料中不一定含氧气,故选项错误.
C、氧化物中含有氧元素,可能用来制氧气,但含有氧元素的物质均有可能,不一定是氧化物,故选项错误.
D、水中含有氧元素,可用来制氧气,但含有氧元素的物质均有可能,不一定是水,故选项错误.
故选A.
点评: 本题难度不大,考查学生对元素的概念的理解和应用,理解质量守恒定律,能从元素及元素守恒的角度进行分析解答是正确解答本题的关键.
10.(2013•湘潭)新装修的房间常因苯超标而损害人体健康,苯(以R表示)燃烧的化学方程式如下:2R+15O2![]() 12CO2+6H2O,R的化学式为( )
12CO2+6H2O,R的化学式为( )
A. C4H8 B. C4H10 C. C6H6 D. C6H10
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 根据燃烧的化学方程式为:2R+15O2→12CO2+6H2O,利用质量守恒定律的实质﹣反应前后原子的种类和数目不变来解答.
解答: 解:根据2R+15O2→12CO2+6H2O,及质量守恒定律可知反应前后元素的种类、原子个数前后相等,
反应前后O原子个数相等,
由元素守恒可知,R中一定含有C、H元素,
由原子守恒可知,反应后共12个C原子、12个H原子,
又R的化学计量数为2,则R的化学式为C6H6.
故选C.
点评: 本题考查利用化学方程式来确定物质的化学式及利用物质来书写化学方程式,学生应注意利用元素守恒、原子守恒来分析解答问题,培养良好的学科思维方法
11.(2013•永州)2012年诺贝尔化学奖颁给两位美国科学家,以表彰他们在G蛋白偶联受体领域所作的奠基性贡献.G蛋白偶联受体在新型药物开发应用广泛,它是由上千个氨基酸通过肽键而形成的一类细胞膜蛋白质.你认为G蛋白偶联受体中一定不含有的元素是( )
A. C B. O C. N D. Ne
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 根据质量守恒定律,化学反应前后元素的种类不变进行解答.
解答: 解:根据题中信息“G蛋白偶联受体是由上千个氨基酸通过肽键而形成的一类细胞膜蛋白质”,根据质量守恒定律,化学反应前后元素的种类不变,氨基酸由碳、氢、氧、氮等元素组成,因此G蛋白偶联受体中一定不含有的元素是Ne;
故选D.
点评: 本题难度不大,掌握质量守恒定律的内容,根据化学反应前后元素的种类不变进行分析即可.
12.(2013•永州)硝酸是一种具有强氧化性的酸,它不仅能与活泼金属发生反应,也能与许多不活泼金属发生反应.其中金属铜与稀硝酸反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2X↑+4H2O,则X的化学式为( )
A, . NO2 B. NO C. N2O D. N2O4
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 根据反应的化学方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2X↑+4H2O,利用反应前后原子种类、数目不变,推断生成物X的化学式.
解答: 解:从反应的化学方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2X↑+4H2O看,反应前3Cu、8HNO3中含Cu、H、N、O四种元素的原子个数分别为3、8、8、24,反应后3Cu(NO3)2、4H2O中含Cu、H、N、O四种元素的原子个数分别为3、8、6、22,根据反应前后原子种类、数目不变,可判断2X中含2个N原子和2个O原子,则每个X分子由1个N原子、1个O原子构成,则物质X的化学式为NO;
故选B.
点评: 根据反应的化学方程式,利用反应前后原子种类、数目不变,可推断反应中某物质的分子构成、确定该物质的化学式.
13.(2013•株洲)右图表示氢气和氧气发生的化学反应,下列说法正确的是( )
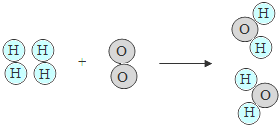
A. 分子是化学变化中的最小微粒
B. 每个氢分子由2个氢原子构成
C. 每个水分子是由2个氢分子和1个氧分子构成的
D. 化学反应前后原子数和分子数均不会发生变化
考点: 微粒观点及模型图的应用.
专题: 化学反应模拟图型.
分析: 根据图示进行分析解答即可.对比反应前后微粒的变化,分析分子、原子的变化,分子的构成等.
解答: 解:A、由图是可知,在化学变化中氢分子和氧分子变化成了水分子,分子发生了变化.故A说法不正确;
B、由氢分子的构成可知,每个氢分子由2个氢原子构成,故B说法正确;
C、由水分子的构成可知,每个水分子是由2个氢原子和1个氧原子构成的.故C说法不正确;
D、对比反应前后微粒的变化可知,化学反应前后原子的数目和种类均不会发生,分子的种类一定发生改变,分子的数目不一定发生改变.故D说法不正确.
故选B.
点评: 此类试题属于图示题,解答时一定要弄清各原子或各分子所表示的意义,并能把微观粒子与宏观物质很好的联系起来,才能根据微观粒子来推测物质的种类与反应类型.
14.(2013•株洲)某纯净物X在空气中燃烧,反应的化学方程式为:3X+2O2![]() 2CO+CO2+3H2O,则X的化学式(分子式及有机物的结构简式等都可称为化学式)为( )
2CO+CO2+3H2O,则X的化学式(分子式及有机物的结构简式等都可称为化学式)为( )
A. C3H6 B. CH3OH C. HCHO D. HCOOH
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: 由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.
解答: 解:根据反应的化学方程式3X+2O2![]() 2CO+CO2+3H2O,反应物中氧原子个数分别为4,反应后的生成物中碳、氧、氢原子个数分别为3、7、6,根据反应前后原子种类、数目不变,则3X中含有3个碳原子、3个氧原子和6个氢原子,则每个X分子由1个碳原子、1个氧原子、2个氢原子构成构成,则物质X的化学式为HCHO.
2CO+CO2+3H2O,反应物中氧原子个数分别为4,反应后的生成物中碳、氧、氢原子个数分别为3、7、6,根据反应前后原子种类、数目不变,则3X中含有3个碳原子、3个氧原子和6个氢原子,则每个X分子由1个碳原子、1个氧原子、2个氢原子构成构成,则物质X的化学式为HCHO.
故选C.
点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.
15.
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1

