| 上传:邓菘化学 | 审核发布:admin | 更新时间:2016-5-10 19:49:41 | 点击次数:527次 |

答:理论上需要钠的质量为4.6kg.
【解析】钠原子核内有11个质子,核外共11个电子,分三层排布,第一层2个电子,第二层8个电子,第三层1个电子;在化学反应中易失去一个电子,形成带一个单位正电荷的钠离子;金属钠与水反应,生成氢氧化钠和氢气,碳酸氢钠分解生成碳酸钠、水和二氧化碳,书写化学方程式时,要注意质量守恒,正确对方程式进行配平;溶质的质量等于溶液的质量乘以溶液浓度,配制溶液时,如果采用俯视读数取水的话,会使实际取水量偏小,导致所配溶液的浓度;过氧化钠部分变质,说明固体中依然含有过氧化钠,溶于水时要和水反应释放出氧气,所以将固体样品溶于水时,固体全部溶解,同时会产生气泡;因为固体样品中含有碳酸钠,碳酸钠的存在,对氢氧化钠的检测有干扰,因此要检测溶液中含有氢氧化钠,必须先排除碳酸钠的干扰,采用的操作方法是:先向溶液中加入足量的氯化钙溶液,至溶液中不再产生沉淀为止,取上层清液滴加无色酚酞溶液,如果溶液变红,则可说明溶液中含有氢氧化钠;根据钠和四氯化钛反应的化学方程式,可以求出所需要的金属钠的质量。
29.(2015•北京)(5分)阅读下面科普短文(原文作者:段翰英等)。
我国制作泡菜的历史悠久。制作泡菜是把新鲜蔬菜泡在低浓度的盐水里,经发酵而成。泡菜品种繁多、风味独特、口感鲜脆。
蔬菜中含有硝酸盐。硝酸盐对人体无直接危害,但转化成亚硝酸盐后,就会产生危害。亚硝酸盐[如亚硝酸钠(![]() )]与胃酸(主要成分是盐酸)反应,产生亚硝酸(
)]与胃酸(主要成分是盐酸)反应,产生亚硝酸(![]() )和氯化物(如
)和氯化物(如![]() )。亚硝酸不稳定,产生的二氧化氮进入血液与血红蛋白结合,导致中毒。
)。亚硝酸不稳定,产生的二氧化氮进入血液与血红蛋白结合,导致中毒。
泡菜中含亚硝酸盐吗?含量有多少?含量受什么因素影响呢?
经实验测定发现,食盐水浓度和泡制时间对泡菜中亚硝酸盐含量有一定影响。下图为室温下,食盐水浓度和泡制时间与芹菜泡制过程中亚硝酸盐含量的关系。
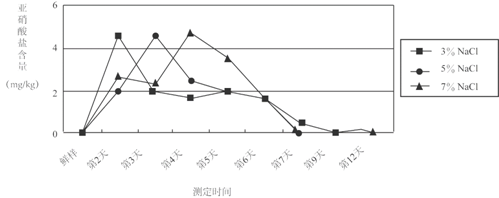
用不同的蔬菜进行测定,变化趋势与芹菜相似。
实验表明,发酵温度对泡菜中亚硝酸盐的生成量及生成时间也具有明显的影响。泡菜发酵过程中,泡制温度较高时,亚硝酸盐含量最大值出现的早,且数值低。这与温度较高有利于乳酸菌的繁殖有关。
实验还表明,泡制过程中添加姜汁和维生素C,都能有效地减少亚硝酸盐的生成。
现代医学证明,泡菜中的乳酸和乳酸菌对人体健康有益,具有抑制肠道中的腐败菌生长、降低胆固醇等保健作用。但是,有些泡菜盐分或糖分过高,对高血压和糖尿病等慢性病患者不利。另外,泡制过程也会造成某些营养素的流失。(有删改)
依据文章内容,回答下列问题。
⑴泡菜中的亚硝酸盐是由 转化生成的。
⑵亚硝酸钠能与盐酸反应,该反应属于基本反应类型中的 反应。
⑶室温下,用芹菜制作的泡菜,最佳食用时间是 (填字母序号,下同)。
A.泡制2-3天 B.泡制5-6天 C.泡制12天后
⑷下列关于制作泡菜的说法中,合理的是 。
A.最好加入一些姜汁
B.最好在较低温度下泡制
C.最好加入一些富含维生素C的水果
D.最佳食用期的泡菜中亚硝酸盐的含量与泡制时的食盐水浓度无关
⑸请你为喜欢吃泡菜的人提一条食用泡菜的建议: 。
【答案】(1)硝酸盐 (2)复分解 (3)C (4)A、C、D
(5)食用超过12天的泡菜或合理食用泡菜的量
【解析】(1)题中给出信息“蔬菜中含有硝酸盐。硝酸盐对人体无直接危害,但转化成亚硝酸盐后,就会产生危害。”
(2)![]() +HCl==
+HCl==![]() +
+![]() ,属于复分解反应;⑶由图像可以看出,室温下,用芹菜制作的泡菜,12天后亚硝酸盐的含量最低,故最佳食用时间是12天后。⑷实验还表明,泡制过程中添加姜汁和维生素C,都能有效地减少亚硝酸盐的生成。泡菜发酵过程中,泡制温度较高时,亚硝酸盐含量最大值出现的早,且数值低。故制作泡菜时最好加入一些姜汁和富含维生素C的水果,在较高温度下泡制。由图像可以看出,不同浓度的食盐水在泡制12天后,亚硝酸盐的浓度几乎相同。
,属于复分解反应;⑶由图像可以看出,室温下,用芹菜制作的泡菜,12天后亚硝酸盐的含量最低,故最佳食用时间是12天后。⑷实验还表明,泡制过程中添加姜汁和维生素C,都能有效地减少亚硝酸盐的生成。泡菜发酵过程中,泡制温度较高时,亚硝酸盐含量最大值出现的早,且数值低。故制作泡菜时最好加入一些姜汁和富含维生素C的水果,在较高温度下泡制。由图像可以看出,不同浓度的食盐水在泡制12天后,亚硝酸盐的浓度几乎相同。
10.(2015•浙江嘉兴)未经处理的工业废水会严重污染水和土壤,某种新型催化剂可有效降解工业废水中的有机污染物,为探究该催化剂降解有机污染物的速度都受那些因素影响,学习小组进行了如下实验.
取四份等质量的某有机物,控制条件如图,然后进入等量的新型催化剂,取得该有机物被降解的百分比随时间变化的关系如下表:
|
时间(分) 有机物被降解百分比(%) 组别 |
0 |
5 |
10 |
15 |
|
A |
0 |
10 |
40 |
60 |
|
B |
0 |
40 |
80 |
100 |
|
C |
0 |
30 |
60 |
90 |
|
D |
0 |
0 |
0 |
0 |
请回答下列问题:
(1)实验中设置A和D组的目的是探究 对降解反应速度的影响;
(2)实验A,B,C三组结果表明,当pH相等时,温度升高,降解反应速度 (选填“先增大后减小”或“先减小后增大”);
(3)部分同学认为pH=3时,40℃是该催化剂最合适的温度,但有同学并不认同,为寻找该催化剂最合适的温度,他应该采取的做法是 ;
(4)实验中若要测定某一时刻有机物被降解的百分比,需要迅速把试管中液体的pH调到10,这样做的目的是 .
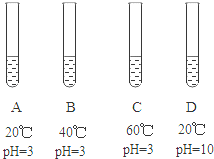
【答案】Ph;先增大后减小;在40℃附近多设置几组进行实验;使反应立即停止
【解析】对比实验,目的是控制实验变量,根据A和D所设置的实验可以看出,A和D的区别在于溶液的PH值不同,所以,该组实验是探究酸碱度对对反应的影响;对比ABC三组实验结果可以看出,PH值是相等的,但温度不等,所以ABC探究的温度的影响,从图示结果可以看出,温度升高,降解速度会先增大,然后再减小;要想确定40℃是否是该催化剂最合适的温度,可以在该温度范围内多做几组以照实验进行验证;根据表格的信息可以知道,D组几乎没有发生反应,说明溶液的PH值在10的时候,发生是停止的,应该可以溶液的PH立即达到10。
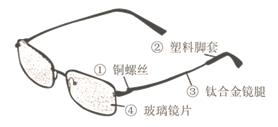
37.(2015·湖南娄底)眼镜是人们常用的护眼工具,下图是一款变色眼镜的示意图:
 |
请回答下列问题:
(1)图中所标物质属于有机合成材料的是 41 (填序号)
(2)该款变色眼镜的玻璃里加入了溴化银(AgBr)和氧化铜。在强光照射下,溴化银分解成单质溴(Br2)和银,玻璃颜色变深,该反应的化学方程式为 42 ;当光线变暗时,溴和银在氧化铜作用下,又立即化合成溴化银,玻璃颜色变浅。氧化铜在该反应中起 43 作用。
【答案】41.② 42.2AgBr![]() 2Ag+Br2
43.催化
2Ag+Br2
43.催化
【解析】(1)①③属于金属材料;②属于有机合成材料;④属于无机非金属材料;(2)由题中信息分析可得出该反应的化学方程式为,氧化铜在该反应中的作用为催化作用。
14.(2015·四川雅安)(10分)生活中处处有化学,化学与生活密切相关。
(2)某饼干包装袋中用作干燥剂的是生石灰,请用化学方程式表示其原理 。
(3)森林火灾时,常砍伐出一条隔离带的目的是 。
(4)我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 功能。
(5)雾霾是一种灾害性天气现象,由于人类生产、生活向大气中排放大量细颗粒物,如果超过大气的自净能力,就会出现雾霾现象.请分析下列污染物中,会导致雾霾的是
(填序号).
A.二氧化硫 B.臭氧 C.一氧化碳 D.PM 2.5
(6)厨房中的下列物品所使用的主要材料属于合成材料的是 。
A 不锈钢炊具 B 橡胶手套 C 纯棉围裙
(7)对自行车的支架进行喷漆处理可以防止其生锈,原因是 。
(8)当汽车受撞击后,汽车安全气囊中的NH4NO3固体瞬间分解成N2O和一种常温下的无色液体,反应方程式是 。
【答案】(1)食醋(合理即可) (2)CaO+H2O=Ca(OH)2 (3)隔离可燃物 (4)乳化 (5) D (6)B (7)隔离空气(或氧气) (8) NH4NO3 =N2O + 2H2O
【解析】(1)皂角素呈碱性,利用中和反应原理可用酸性物质中和以除痒,在厨房中可用呈酸性的食醋涂抹;(2)生石灰可吸收空气中的水分而变成熟石灰,从而起到干燥剂的作用,发生反应的化学方程式为:CaO+H2O=Ca(OH)2;(3)森林火灾中砍伐隔离带的目的是清除或隔离可燃物;(4)由于洗涤剂具有乳化功能,可将油污乳化而除去,所以可用洗涤剂清除餐具上的油污;(5)造成雾霾的污染物是固体颗粒状物质,故二氧化硫、臭氧、一氧化碳等气体不是造成雾霾的原因,PM2.5是直径小于2.5微粒的固体颗粒污染物,是造成雾霾的主要原因;(6)不锈钢属于金属材料,橡胶属于合成材料,纯棉属于天然材料;铁生锈是铁与水、空气共同作用的结果,在自行车支架上喷漆可防止水和氧气与铁接触而生锈;由硝酸铵的组成元素可知,该物质分解后产生一氧化二氮和另一种无色液体,该液体由氢、氧元素组
成,即无色液体是水,发生反应的化学方程式为:NH4NO3 =N2O + 2H2O。
(2015•山东济宁)(3分)84消毒液是一种有刺激性气体的高效液体消毒剂,主要成分为次氯酸钠(NaClO),广泛用于宾馆、旅游、医院、食品加工、家庭等的卫生消毒。请阅读信息并回答:
(1)次氯酸钠的制取原理是氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水化学反应方程式为__________________________;
(2)消毒液中次氯酸钠自身没有消毒作用,有消毒作用的是次氯酸钠与空气中二氧化碳反应得到的次氯酸(HClO),化学方程式为______________________________;
(3)84消毒液是含氯消毒剂,氯气是一种挥发性的有毒气体,因此,84消毒液必须__________保存。
【答案】(1)2NaOH + Cl2 = NaCl + H2O + NaClO
(2)2NaClO + CO2 + H2O = Na2CO3 + 2HClO
(3)密封
【解析】(1)考察化学方程式的书写,本题较简单,已知反应物和生成物,注意配平即可。(2)本题较难,只告诉了部分反应物和生成物,要根据质量守恒定律推断其他的反应物和生成物。生成物中有HClO,可推知反应物中需要水。反应前有Na、Cl、O、 C、H等元素,可推知生成物中还有Na2CO3。(3)因为氯气是一种挥发性的有毒气体,因此,84消毒液必须密封保存。
21.(2015·山东滨州)如图是同学们经常使用的交通工具--自行车,请完成下列各题:
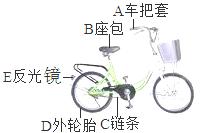
(1)所标各部件中由金属材料制成的是 (填序号),属于有机合成材料的有 (任选一种物质填序号);
(2)车轮的钢圈在潮湿的空气中会锈蚀,这是铁与空气中的 、水蒸气等物质发生化学反应的结果;通常用盐酸除铁锈,该反应的化学方程式为: ;
(3)新型食品保鲜剂“纳米α铁粉”被称为“双吸剂”,其实质就是利用了铁生锈的原理。若用化学方法检验使用一段时间后的“纳米α铁粉”是否完全失效,可选用 检验,若出现 的现象,说明该双吸剂仍可使用。
【答案】(1)C;A或B或D或E;(2)氧气;6HCl+Fe2O3═2FeCl3+3H2O;(3)磁铁或稀盐酸或硫酸铜溶液;有黑色粉末被吸引或有气泡冒出或有红色沉淀生成。
【解析】此题结合生活常识考查了化学材料、金属生锈、金属除锈和物质检验等知识。(1)根据标示的各部件,其中链条是金属材料制成的;其余的均为有机合成材料制成的;(2)铁生锈需要与氧气和水蒸气接触;稀盐酸除铁锈的方程式为:6HCl+Fe2O3═2FeCl3+3H2O;(3)检验铁粉的方法很多,比如用磁铁吸引,若有黑色粉末被吸引或滴加稀盐酸有气泡冒出或加入硫酸铜溶液有红色沉淀生成等合理均可。
三、实验探究题
22. (2015•广东佛山)(7分)现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解]。
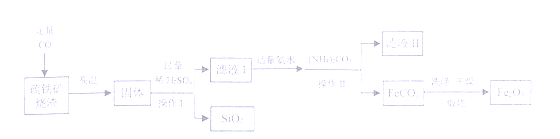
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、 等。
(2)滤液Ⅰ中主要的阳离子是 等。
(3)加适量氨水的目的是 。
(4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是 。
(5)滤液Ⅱ中可回收的产品是 (写化学式)。
(6)写出在空气中煅烧FeCO3的化学反应方程式 。
【答案】(1)漏斗
(2)H+ Fe2+ (3)中和过量的H2SO-4
(4)控制溶液的温度在40℃以下【按:溶液酸碱度也必须控制,因为碱性过强有可能生成氢氧化亚铁,酸性过强就不可能得到碳酸盐】(5)(NH4)2SO4 (6)4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
【解析】操作I和操作II的名称都是过滤,所用的主要仪器包括玻璃棒、烧杯和漏斗等;硫铁矿烧渣在一氧化碳还原下,得到铁和二氧化硅,然后与足量的硫酸反应,生成硫酸亚铁,所以滤液I中的阳离子包括亚铁离子,以及过量硫酸中所含有的氢离子;氨水显碱性,可中和过量的硫酸,得到硫酸铵,用碳酸铵和硫酸亚铁反应,可得到碳酸亚铁,碳酸铵在40℃以上时就会分解,所以使用碳酸铵必须控制溶液的温度在40℃以下才行,最终在滤液II中回收的产品应该是硫酸铵;碳酸亚铁分解生成氧化铁和二氧化碳。
28.(2015•四川德阳)(6分)工业烟气通常含有二氧化硫,在排放前需经脱硫处理。右下图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略)。
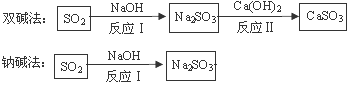
请回答下列问题:
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅱ所属的基本反应类型是 ,
CaSO3中Ca、S、O元素的质量比是 。
(3)已知原料NaOH的价格为2.9元/kg、Ca(OH)2的价格为0.36元/kg。两种工艺中,处理相同质量的SO2,双碱法所需的原料成本更低,其原因是 。
【答案】(1)SO2 +2NaOH = Na2SO3+H2O (2)复分解反应;5:4:6 (3)反应Ⅱ Na2SO3+Ca(OH)2=CaSO3+2NaOH,反应生成了NaOH,实现了NaOH的循环利用,因此降低了成本。
【解析】(略)
19.(2015•江西)(5分)炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:
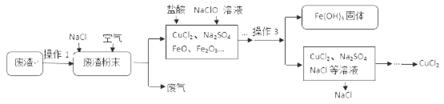
(1)操作1:粉碎。粉碎的目的是 ;
(2)操作2:焙烧。高温条件下,通入空气,CuS和NaCl反应生成了CuCl2和Na2SO4,反应的化学方程式为 ;
(3)操作3: (填操作名称);
(4)流程图中可循环利用的物质是 。
【答案】(5分)(1)增大反应物的接触面积 (2)CuS+2NaCl+2O2![]() CuCl2+Na2SO4
(2分) (3)过滤 (4)氯化钠(或NaCl)
CuCl2+Na2SO4
(2分) (3)过滤 (4)氯化钠(或NaCl)
【解析】粉碎可以增大固体的比面积,增大反应物间的接触面积,一方面可以加快反应速率,只一方面可反应更充分;焙烧时,通入空气,硫化铜和氯化钠反应生成氯化铜和硫酸钠,对比反应前后元素的种类,可确定空气在焙烧时提供氧气,所以该反应的反应物为氧气、硫化铜和氯化钠,生成物是氯化铜和硫酸钠,反应条件是高温;操作3得到难溶于水的固体和溶液,即操作3是分离不溶性固体与液体的操作,所以该操作是过滤;流程图中氯化钠可循环利用。
四、分析与计算
,
专题一、信息给予题
一、选择题
8. (2015•黑龙江大庆)下列物质的转化过程不符合A⇌B→C的是()
A. CO⇌CO2→CaCO3
B. CO2⇌C6H12O6→H2O
C. O2⇌H2O→H2
D. Cu⇌CuO→Cu(OH)2
【答案】D
【解析】根据题给信息可知,AB之间可以相互转系,B还可以转化成C,选项A中,一氧化碳和二氧化碳可以相互转化,二氧化碳和碳酸钙之间也可以相互转化,;选项B中二氧化碳和葡萄糖之间可相互转化,葡萄糖和水之间也可以相互转化;选项C中氧气和水之间可以相互转化,水可以生成氢气,选项D中铜和氧化铜可以相互转化,但氧化铜不能转化成氢氧化铜;所以本题的答案是D.
17. (2015•广东佛山)元素化合价发生改变的反应都是氧化还原反应。例如:2Fe+3Cl2——2FeCl3,反应前后,Fe和Cl元素的化合价发生了改变,该反应是氧化还原反应。下列反应不属于氧化还原反应的是( )
A.4P+5O2——2P2O5
B.FeCl3+3NaOH——Fe(OH)3↓+3NaCl
C.Zn+H2SO4——ZnSO4+H2↑
D.2H2O——2H2↑+O2↑
【答案】B
【解析】根据题意,不属于氧化还原反应的应该是反应前后各元素的化合价没有发生变化的那个反应。反应A是由单质参与的化合反应,元素化合价发生变化;选项C是置换反应,元素化合价在反应前后必须发生改变;选项D是由单质生成的分解反应,元素化合价也发生了变化,只有选项B是复分解反应,反应本质是反应物相互交换成分,元素化合价在反应前后没有发生变化,所以它不属于氧化还原反应。
15. (2015·江苏泰州)有一类化合物其化学式可表示为CnH2n+2(n≥1,n为正整数),这类化合物统称为烷烃。下列有关烷烃的说法中,正确的是( )
A.甲烷(CH4)是最简单的烷烃
B.烷烃在氧气中完全燃烧时,产生CO2和H2O
C.烷烃都属于有机高分子化合物
D.烷烃中碳元素的质量分数随n的增大而变小
【答案】AB
【解析】CH4中C、H的原子个数关系符合烷烃的化学式通式,且n为最小值1,所以是最简单的烷烃,它还是最简单的有机物;烷烃都由谈情元素组成,燃烧时会产生二氧化碳和水,故A、B是正确的;有的烷烃比较简单(n值较小时),不能被成为有机高分子化合物;烷烃中碳原子个数越多,碳元素质量所占比例越大,质量分数会随n值得增大而增大,故D错。
6、(2015·安徽)“超临界水”因具有许多优良特性被科学家追捧,它是指当温度和压强达到一定的液态和气态完全交融在一起的流体。下列有关“超临界水”的说法正确的是( )
A.它是混合物 B.它是一种不同于水的新物质
C.它的分子之间有间隔 D.它的一个分子由4个氢原子和2个氧原子构成
6、C【解析】此题属于新信息题。由题目信息可知:“超临界水”是温度和压强达到一定的液态和气态完全交融在一起的一种水。是纯净物,一个分子由2个氢原子和1个氧原子构成,分子之间存在一定的间隔,故正确的是C。
19.(2015•北京)纳米材料具有特殊的性质和功能。纳米二氧化钛![]() 参与的光催化反应可使吸附在其表面的甲醛等物质被氧化,降低空气中有害物质的浓度。正钛酸
参与的光催化反应可使吸附在其表面的甲醛等物质被氧化,降低空气中有害物质的浓度。正钛酸![]() 在一定条件下分解失水可制得纳米
在一定条件下分解失水可制得纳米![]() 。下列说法不正确的是
。下列说法不正确的是
A.甲醛对人体健康有害
B.纳米![]() 添加到墙面涂料中,可消除甲醛
添加到墙面涂料中,可消除甲醛
C.纳米![]() 与普通的
与普通的![]() 的性质、功能完全相同
的性质、功能完全相同
D.制备纳米![]() 的反应:
的反应:![]()
【答案】C
【解析】甲醛会与人体中的蛋白质发生反应,破坏蛋白质的结构,使其变质,危害人体健康;纳米二氧化钛参与的光催化反应可使吸附在其表面的甲醛等物质被氧化,降低空气中有害物质的浓度,故纳米![]() 添加到墙面涂料中,可消除甲醛;纳米材料具有特殊的性质和功能,故C错;正钛酸
添加到墙面涂料中,可消除甲醛;纳米材料具有特殊的性质和功能,故C错;正钛酸![]() 在一定条件下分解失水可制得纳米
在一定条件下分解失水可制得纳米![]() ,反应的化学方程式为
,反应的化学方程式为![]()
二、填空、简答题
23、(2013•河南)钠及其化合物是中学化学学习和研究的重要内容。
(1)右图是钠的原子结构示意图。下列说法不正确的是 。
a.钠属于金属元素 b.钠原子的质子数为11
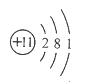
c.钠离子的符号为Na+ d.钠在化学反应中易得到电子
(2)钠与水反应生成氢氧化钠和氢气,化学方程式为 ,小苏打受热分解成碳酸钠、二氧化碳和水,化学方程式为 。
(3)配制一瓶右图溶液需氯化钠 g;

配制 50 g6% 氯化钠溶液,若用量筒量取水时俯视读数(其他操作正确),则溶液的质量分数 .6%(填 “>”、“<”或“= ”)。
(4)已知:2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2。实验室 敞口放置的过氧化钠(Na2O2),已部分变质,取少量该固体样品于试管中,加足量水,可观察到什么现象?如何检验该水溶液中含有的氢氧化钠?(请简要写出实验步骤和现象)
(5)钛和钛合金性能优良,广泛用于航空、造船和化学工业中。工业上常用钠来制取 钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛。若要用该方法制取2.4Kg钛, 理论上需要钠的质量是多少?
【答案】(1) d;〔2)2Na十2H2O 二2NaOH十H2 ↑;2NaHCO3 △==== Na2CO3+H2O+CO2↑;(3) 4.5 ;>; (4) 固体溶解,有气泡产生;向该试管中滴加足量的CaCl2溶液(或BaCl2溶液等),静置,取上层清液,向其中 滴加酚酞溶液,溶液变红。
(5〉解:设理论上需要钠的质量为x。
4Na+Ti Cl 高温===== 4NaCl+Ti
4x23 48
X
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1

