| 上传:夏尊华化学 | 审核发布:admin | 更新时间:2016-1-22 20:41:29 | 点击次数:344次 |
|
课 题 |
化学平衡移动(一) |
课 型 |
新授课 |
|||||||||||||||||
|
课 时 |
课时 |
主备课人 |
袁希望 |
|||||||||||||||||
|
复备课人 |
|
审核人 |
唐高明 |
|||||||||||||||||
|
课前准备 |
多媒体课件,相关实验仪器 |
|||||||||||||||||||
|
教 学 目 标 |
知识与技能:(1)理解浓度、温度等条件对化学平衡的影响。 (2)理解化学平衡移动原理并应用。 |
|||||||||||||||||||
|
过程与方法:(1)通过从浓度、温度对化学平衡影响总结出化学平衡移动原理,培养和训练抽象概括能力。 (2)通过有关化学实验的观察和分析,提高对实验现象的观察能力和分析实验现象能力。 |
||||||||||||||||||||
|
情感态度与价值观:通过对化学平衡中相关问题的逻辑推理,培养学生热爱化学的优良品质。 |
||||||||||||||||||||
|
教学重点 |
浓度、温度对化学平衡的影响 |
|||||||||||||||||||
|
教学难点 |
浓度、温度对化学平衡的影响 |
|||||||||||||||||||
|
教学过程和教学内容 |
二次备课 |
|||||||||||||||||||
|
【复习】1.影响化学反应速率的因素有哪些? 2.什么是化学平衡,化学平衡时有哪些主要的特征?化学平衡受哪些因素的影响? 3.如果对一个处于化学平衡的反应改变条件,一段时间后,它还会平衡吗? 【新课引入】如果我们在改变外界条件(温度、浓度、压强)时,平衡状态会发生改变,经过一段时间又会重新建立一个新的平衡状态。 【板书】化学平衡的移动 原平衡状态→平衡移动的过程→新平衡状态 (v正=v逆) (v正≠v逆) v′正=v′逆 v正>v逆 正移 v正﹤v逆 逆移 一 浓度对化学平衡的影响 【实验2-5】 Cr2O+H2O2CrO+2H+ 橙色 黄色 向试管中加入4 mL 0.1 mol·L-1的K2Cr2O7溶液
【解释】增大生成物浓度,v逆瞬间增大,v正保持不变, v正﹤v逆 逆移,随后v逆慢慢减小,v正慢慢增加,直至V正’ =V逆达到新的平衡。 减小生成物浓度,v逆瞬间减小,v正保持不变, v正﹥v逆 正移,随后v逆慢慢增大,v正慢慢减小,直至V正’ =V逆达到新的平衡。
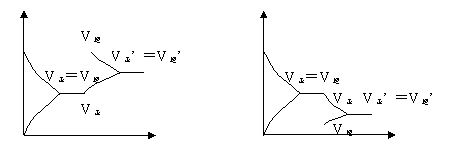 【实验2-6】将10mL0.01mol/L的KSCN溶液与10mL0.01mol/L的FeCl3溶液相混合,(1)继续滴加1mol/L的KSCN溶液,(2)继续滴加饱和FeCl3溶液,预测现象,并画出v-t图像作出解释。 【总结】 二.温度对化学平衡的影响。
置于冰水(降低温度):棕红色变浅(平衡正移)。 置于热水(升高温度):红棕色变深(平衡逆移)。 【解释】实验测得,吸热反应受温度影响更明显。 升高温度,正逆反应速率均增大,但逆反应增大更多,使v正﹤v逆 逆移,v逆随后慢慢减小,v正慢慢增加,直至V正’ =V逆达到新的平衡。 降低温度,正逆反应速率均减小,但逆反应减小更多,使v正﹥v逆 正移,随后v正慢慢减小,v逆慢慢增加,直至V正’ =V逆’达到新的平衡。
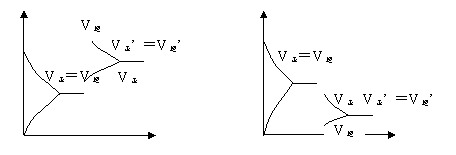
【思考】N2O4 2NO2 △H﹥0,升高温度和降低温度,气体颜色怎么变? 【总结】升高温度,平衡向吸热反应方向移动。 降低温度,平衡向放热反应方向移动。 |
|
|||||||||||||||||||
|
教学札记: |
||||||||||||||||||||
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1