| 上传:夏尊华化学 | 审核发布:admin | 更新时间:2015-5-27 16:48:54 | 点击次数:1238次 |
生活中两种常见的有机物 乙醇
一、教材分析
1、教材内容分析
《乙醇》是新课标人教版高中化学必修2第三章《有机化合物》第三节《生活中两种常见的有机物——乙醇和乙酸》中的第一课时的内容。这节课选取了日常生活中典型的有机物代表——乙醇,在学生初中已对乙醇有了初步认识的基础上,主要介绍乙醇的组成、结构、主要性质以及在生活、生产中的应用。
在化学必修2《有机化合物》中对官能团的学习有所体现但没有强化,学生主要学的是与日常生活相关的一些重要有机物的知识。在选修模块《有机化学基础》中对有机物知识的系统性则要求很高。这种设计应该是新的课程标准注重选择性与教学目标的多样性的必然结果。因此,我认为在本节的教学中我们并不需要去追求知识的系统性,亦不需要过多的知识迁移,不需要强化有机物的衍生转化关系,这些工作留待学生选修《有机化学基础》模块后再去做。我们只需踏踏实实地按课本设置的学习内容引导学生学好,与生活多联系。多留一点时间去改变学生的学习方式,多留一点时间让学生去体验、感知学习化学的乐趣、体验成功的快乐,多留一点时间去提高学生的综合素质。
教学中注意从结构的角度深化学生对乙醇的认识,建立有机物“组成、结构、性质、用途”的认识关系,通过乙醇的学习,使学生了解学习和研究有机物的一般方法,形成一定分析和解决问题的能力。
2、教材的地位和作用
乙醇是联系烃和烃的衍生物的性质的桥梁,它在有机物的相互转化中处于核心地位。学好本节课的内容对学习其他烃的衍生物的性质具有指导性作用。可以让学生掌握在烃的衍生物的学习中,抓住官能团的结构和性质这一中心,确认结构决定性质这一普遍性规律,既巩固了前面学习的烃的知识,又为后面其它烃的衍生物的学习打下了坚实的基础。因此本节在本章的教学中起到了承上启下的作用,是本章的重点内容之一。
3、教学目标
(1)知识与技能目标
①掌握乙醇的结构式、物理和化学性质;认识乙醇在日常生活中的应用。
②了解羟基的特性,进一步理解和掌握“官能团”的概念。
(2)过程和方法目标
①通过科学探究活动,了解科学探究的方法,提高运用实验探索解决新问题的能力。
②进行观察与思考,培养观察能力,逻辑推理能力、实验操作技能力。
③通过从官能团的结构特点入手来分析物质性质的“思路教学”,使学生学会研究有机化学的科学方法。
(3)情感、态度、价值观目标
①学习乙醇的分子结构,体会物质的微观结构之美。
②获得物质的结构决定性质的科学观点,学会以点带面的学习方法。
③通过乙醇用途的介绍培养学生将化学知识应用于生产、生活的意识,关注与化学有关的社会热点问题(假酒、乙醇汽油等),培养可持续发展的思想。
④介绍酒和酒精的有关知识,体会化学化工为人类社会创造了美。另外,酒在给人类社会带来美的享受的同时,也带来一定的危害,甚至可能导致严重的社会问题,对学生进行美与丑的辩证关系的教学。
4、教学重点、难点
(1)教学重点 乙醇分子结构的确定和乙醇的化学性质
(2)教学难点 乙醇的性质及与结构之间的关系
对于重点、难点的突破,我设计了三个突破点:①乙醇结构的特点可通过化学计算和分子模型来推导,电脑多媒体技术展示来确定,充分发挥以教师为主导学生为主体的作用,使学生在掌握乙醇结构的同时,也学会了归纳演绎的学习方法;②通过实验探究和动画演示的办法帮助学生认识和掌握乙醇的化学性质;③在烃的衍生物的教学中,抓住官能团的教学中心点与化学反应中化学键断裂受反应条件的影响两条主线。
二、教法分析
教学设计中,在学生初中知识的基础上,突出从烃到烃的衍生物的结构变化,强调官能团与性质的关系,在学生的头脑中逐步建立烃基与官能团位置关系等立体结构模型,帮助学生打好进一步学习的方法论基础,同时鼓励学生用学习到的知识解释常见有机物的性质和用途。教学活动是教与学的双边活动,必须充分发挥学生的主体作用和教师的主导作用,使之相互促进,协调发展,根据这一原理和我校学生的实际情况,我设计了如下教学方法:
1、实验法:充分发挥学生主体作用,将教材中演示实验改为学生实验(如乙醇与金属钠的实验、乙醇的催化氧化实验),增加几个探究实验(如乙醇的溶解性实验;乙醇、水和钠的实验;乙醇与重铬酸钾溶液的反应等),设计问题的情景,展示获取知识的过程,按“实验→疑问→思考→引导→探究→得出结论→应用”的模式进行教学,从而调动学生的内在动力,促使学生主动地去探索知识。
2、情境激学法:创设问题的意境(酒的资料收集、酒后驾驶的检验、酒精汽油的推广等),激发学习兴趣,调动学生内在的学习动力,促使学生在意境中主动探究科学的奥妙。
3、现代教育技术辅助教学法:通过动画模拟乙醇的分子结构以及化学反应中分子中的断键情况,将微观现象宏观化,将瞬间变化定格化,有助于学生掌握乙醇化学反应的本质。
4、归纳、演绎法:通过学生的归纳和逻辑推导,最终确定乙醇的物理性质和分子结构。
5、自学、讨论法:通过学生结合生活经验、阅读课本、收集资料,讨论交流,自主归纳、总结乙醇的用途。
三、学情分析和学法指导
1.学情分析
①从学生学习能力上看,经过近一个半学期的高中化学学习,学生已经初步具备了系统知识学习的能力,学会了分析物质结构与性质的关系,具备了一定的提出问题、分析问题、解决问题的能力。
②从学生心理情况看,由于本单元知识十分贴近生活,都是生活中经常接触到的物质,学生的情绪与心理都会处于一种兴奋状态,会产生一种自然的探究欲望,这一点在教学中要把握好,对培养学生学习化学兴趣将会大有帮助。
③在本单元的学习中,学生已经认识了甲烷、乙烯、苯的分子组成、结构特征、主要化学性质及应用,并学会比较各种烃在组成、结构、性质上的差异,也初步了解了有机基团与性质的关系,对于官能团的学习有一定的基础,但毕竟高一学生刚接触有机化学,知识掌握是零乱而不系统的。
2.学法指导
①学好烃的衍生物知识,应抓住有机物分子的关键部位(官能团及其邻近原子),分析有机物在化学反应中的断键本质。有利于学生对所学知识进行迁移,提高知识的应用水平。
②在理解掌握乙醇的断键本质的基础上,注意分析理解乙醇羟基和乙基之间的相互影响,培养用普遍联系的观点分析问题。
③要注意反应条件(外因)的影响,着重把握乙醇的消去、氧化反应及其条件和产物。
四、教学过程

导入新课
让学生展示自己在课前搜集的有关酒类、酒精和乙醇的知识,由教师加以简单分类评析,并以酒的简史,结合我国丰富多彩的酒文化等内容,激发学生学习兴趣。
自学探究
1.阅读课本P73-75中与乙醇有关的内容,完成下列问题:
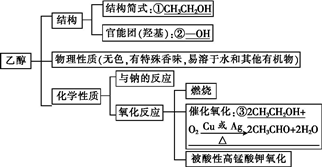
1.乙醇的物理性质
乙醇俗称酒精,无色、有特殊香味的液体,密度比水小,易挥发 ,与水以任意比互溶,是优良的有机溶剂。
2.乙醇的分子结构
|
分子式 |
结构式 |
结构简式 |
官能团 |
|
⑩C2H6O |
|
(或C2H5OH) |
|
3.几个重要概念
(1)官能团
决定有机化合物的化学特性的原子或原子团,如羟基-OH,硝基—NO2,羧基—COOH。
(2)烃的衍生物
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
(3)醇
烃分子中的氢原子被羟基取代而生成的有机物。最简单的醇为CH3OH。
4.乙醇的化学性质
(1)与钠的反应
化学方程式为:2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑。
(2)氧化反应
①燃烧:化学方程式为:C2H5OH+3O2![]() 2CO2+3H2O。
2CO2+3H2O。
②催化氧化:化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
③与酸性高锰酸钾溶液或酸性重铬酸钾溶液反应,被直接氧化成乙酸。
![]()
1.甲苯属于烃的衍生物吗?
【答案】不属于;甲苯分子中只含有C、H两种元素,属于烃,不属于烃的衍生物。
2.乙醇分子中的羟基能电离出H+,乙醇是酸性物质吗?
【答案】不是;乙醇属于中性有机物。
3.能用乙醇萃取溴水中的溴吗?
【答案】不能;因为乙醇易溶于水,不能分层。
课后反思
请将预习中不能解决的问题写下来,供课堂解决。

学始于疑
1.乙醇的结构具有什么特点?其结构与化学性质有什么样的关系?
2.金属钠与水和与乙醇反应有什么不同?
3.乙醇催化氧化的实质是什么?铜丝的作用是什么?铜丝是否参与反应?
质疑探究
探究一 乙醇的分子结构
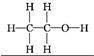
问题1:已知
|
|
甲 |
乙 |
|
分子式 |
C2H6O |
C2H6O |
|
沸点( ℃ ) |
-23 |
78.5 |
试推断甲、乙的结构?
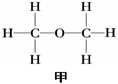
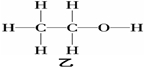
提示:
问题2你是怎样推测出甲、乙结构式的,请说明?
提示:一个乙醇分子里-OH的氢原子跟别的乙醇分子里-OH的氧原子结合成氢键。
问题3:怎样用实验证明乙醇的结构?
提示:乙醇与金属钠的反应
探究二 金属钠与水和与乙醇反应的异同
问题1:已知密度关系为:水>钠>乙醇。请你预测金属钠在水中和在乙醇中反应现象有哪些相同点和不同点?
|
|
钠与水反应 |
钠与乙醇反应 |
|
现 象 |
浮在水面 熔成小球 四处游动 发出嘶嘶的响声 |
开始时沉在乙醇底部 不熔成小球 四处游动 发出嘶嘶的响声 |
|
结 论 |
乙醇羟基中的氢原子不如水中的氢原子活泼 |
|
问题2:钠与乙醇反应要比与水反应缓和的原因是什么?
提示:乙醇分子可以看做水分子里的一个氢原子被乙基(—CH2—CH3)取代后的产物,由于乙基对羟基的影响,使羟基上的氢原子活动性减弱,不如水分子中的H原子活泼,所以乙醇与钠的反应比水与钠的反应要缓和得多。
问题3:除Na外,其他能够与水反应的活泼金属如K、Ca、Mg等是否也能与乙醇反应产生?如果能反应写出反应方程式,并分析这些反应方程式有什么特点?
2CH3CH2OH+2K―→ 2CH3CH2OK+H2↑
2CH3CH2OH+Ca―→ (CH3CH2O)2Ca+H2↑
2CH3CH2OH+Mg―→ (CH3CH2O)2Mg+H2↑
数量关系:1 mol乙醇跟足量Na、 K、Ca、Mg等反应,产生0.5 mol氢气。该关系可以延伸为1 mol羟基跟足量活波金属反应,产生0.5 mol氢气。
问题4:乙醇中—OH和水中的OH-有什么区别?
|
名 称 |
电子式 |
电子数 |
电 性 |
存在形式 |
书写方法 |
|
羟 基 |
|
|
|
|
|
|
氢氧根 |
|
|
|
|
|
问题5:如何检验和除去乙醇中的水?
提示:有时乙醇中会含有少量的水,检验方法:可用无水CuSO4,若无水CuSO4变蓝说明有水存在。除水方法:可先用过量的生石灰吸收乙醇中少量的水,再用蒸馏方法收集纯净的乙醇。
探究三 乙醇的催化氧化反应
问题1:将表面烧黑的热铜丝伸入无水乙醇中,会观察到什么现象?对此你如何解释?用化学方程式如何表示这个过程?
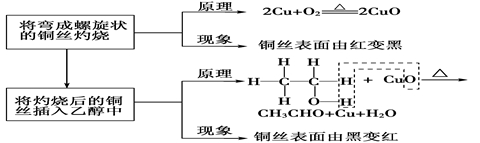
总反应方程式为:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O,反应中Cu作催化剂。
2CH3CHO+2H2O,反应中Cu作催化剂。
问题2:下列醇能发生催化氧化反应,生成醛的是( )

总结:醇在有催化剂(铜或银)存在的条件下,可以发生催化氧化反应生成醛,但并不是所有的醇都能被氧化生成醛。
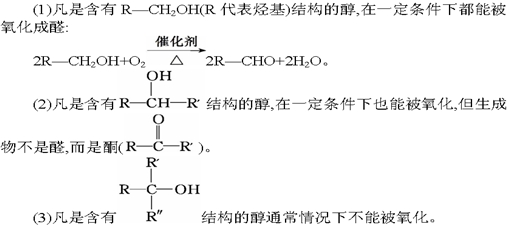
问题3:乙醇能否被酸性高锰酸钾溶液或酸性重铬酸钾溶液等强氧化剂氧化?
K2Cr2O7![]() Cr2(SO4)3
Cr2(SO4)3
上述反应中,被检测的气体是CH3CH2OH,氧化剂是K2Cr2O7;氧化产物是CH3COOH_。

1.下列有关乙醇的物理性质的应用中不正确的是( A )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多种有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
2.酒精完全燃烧后,生成的产物可用一种物质完全吸收,这种物质是( C )
A.浓硫酸 B.浓NaOH溶液 C.碱石灰 D.无水氯化钙
3.下列物质中,分别加入金属钠,不能产生氢气的是( A )
A. 苯 B.蒸馏水 C.无水酒精 D.75%的酒精
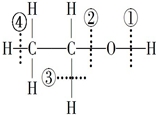 4.乙醇与钠反应时在何处断键( A )
4.乙醇与钠反应时在何处断键( A )
A. ① B. ②
C. ③ D. ④
5.橙花是玫瑰油、马丁香油和香茅油等香精油的主要成分之一,其结构简式如图所示。![]() 下列有关说法不正确的是( D )
下列有关说法不正确的是( D )
A.橙花醇可发生加聚反应生成高分子化合物 B.橙花醇能被酸性高锰酸钾溶液氧化
C.橙花醇既能发生取代反应又能发生加成反应
D.橙花醇能与钠、氢氧化钠溶液、碳酸钠溶液反应

![]()
![]()
。
课后训练
教材P76第1、2、3、8题
【课后拓展】收集查阅资料回答:(3、4任选一个)
1.在焊接铜漆包线的线头时,常先把线头放在火上烧一下,以除去漆层,并立即在酒精中蘸一下再焊接。要在酒精中蘸一下的原因是是什么(用化学方程式表示)
2.工业酒精为何不能勾兑成饮用酒?
3.根据收集的有关酒的资料,结合老师的简单分类和本节学习的知识,选择研究小课题,进行探究。(酒的发展史,酒的酿造、酒的结构与性质,酒文化,酒的用途)
4.小论文:试论饮酒的利与弊(1000字左右)
附:【板书设计】
第二节 乙醇
一、乙醇的物理性质
二、乙醇的分子结构
乙醇的分子式:C2H6O

乙醇的结构简式:CH3CH2OH或C2H5OH 官能团:-OH(羟基)
三、乙醇的化学性质:
1、乙醇与钠的反应
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
2CH3CH2OH+Ca→(CH3CH2O)2Ca +H2↑
2、乙醇的氧化反应
①燃烧:化学方程式为:C2H5OH+3O2![]() 2CO2+3H2O。
2CO2+3H2O。
②催化氧化:化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
小结:羟基决定乙醇的主要化学性质
四、乙醇的用途
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1