| 上传:夏尊华化学 | 审核发布:admin | 更新时间:2016-1-22 22:15:31 | 点击次数:446次 |
|
课 题 |
电解原理的应用 |
课 型 |
新授 |
|
课 时 |
1课时 |
主备课人 |
郭晟 |
|
复备课人 |
|
审核人 |
唐高明 |
|
课前准备 |
相关实验用品 |
||
|
教 学 目 标 |
知识与技能: 知道电解原理的几个重要应用 |
||
|
过程与方法: 培养学生分析生活生产中的问题的能力 |
|||
|
情感态度与价值观: 培养学生的探究精神,学以致用。 |
|||
|
教学重点 |
电解原理的应用 |
||
|
教学难点 |
电解原理的应用 |
||
|
教学过程和教学内容 |
二次备课 |
||
|
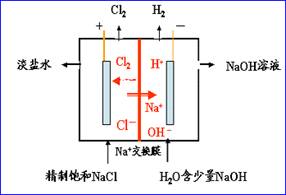
二、电解原理的应用 1、电解饱和食盐水——氯碱工业
阳极:石墨或金属钛 2Cl――2e=Cl2↑ 阴极:铁网 2H++2e=H2↑ 电解质溶液:饱和食盐水 总方程式:2NaCl+2H2O 分析:在饱和食盐水中接通直流电源后,溶液中带负电的OH—和Cl—向阳极移动,由于Cl—比OH—容易失去电子,在阳极被氧化成氯原子,氯原子结合成氯分子放出;溶液中带正电的Na+和H+向阴极移动,由于H+比Na+容易失去电子,在阴极被还原成氢原子,氢原子结合成氢分子放出;在阴极上得到NaOH。 (1)饱和食盐水的精制: 原因:除去NaCl中的MgCl2、Na2SO4等杂质,防止生成氢氧化镁沉淀影响 溶液的导电性,防止氯化钠中混有硫酸钠影响烧碱的质量。 试剂加入的顺序:先加过量的BaCl2和过量的NaOH(顺序可换),再加入过量的Na2CO3,过滤,加盐酸调节pH为7。 (2)隔膜的作用:防止氢气和氯气混合发生爆炸;防止氯气和氢氧化钠反应影响烧碱的质量。 2、电镀 阳极(镀层金属):Cu-2e-=Cu2+ 阴极(镀件):Cu2++2e-=Cu 电镀液:含镀层金属的电解质
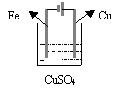
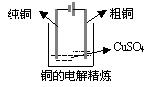
分析:因为由得失电子数目守恒可知,阳极放电形成的Cu2+离子和阴极Cu2+离子放电的量相等,所以电解质溶液的浓度、质量、pH均不会改变。 (1)电镀是电解的应用。电镀是以镀层金属为阳极,待镀金属制品为阴极,含镀层金属离子为电镀液。 (2)电镀过程的特点:牺牲阳极;电镀液的浓度(严格说是镀层金属离子的浓度)保持不变;在电镀的条件下,水电离产生的H+、OH—一般不放电。 3、铜的电解精炼 阳极(粗铜棒):Cu-2e-=Cu2+ 阴极(精铜棒):Cu2++2e-=Cu 电解质溶液:含铜离子的可溶性电解质
分析:因为粗铜中含有金、银、锌、铁、镍等杂质,电解时,比铜活泼的锌、铁、镍会在阳极放电形成阳离子进入溶液中,Zn-2e- = Zn2+ 、Fe-2e- = Fe2+ 、Ni-2e- =Ni2+,Fe2+、Zn2+、Ni2+不会在阴极析出,最终留存溶液中,所以电解质溶液的浓度、质量、pH均会改变。还原性比铜差的银、金等不能失去电子,它们以单质的形式沉积在电解槽溶液中,成为阳极泥。阳极泥可再用于提炼金、银等贵重金属。 4、电解法冶炼活泼金属: (1)电解熔融的氯化钠制金属钠: 2NaCl(熔融) (2)电解熔融的氯化镁制金属镁: MgCl2(熔融) (3)电解熔融的氧化铝制金属铝: 2Al2O3(熔融)
|
|
||
|
教学札记:
|
|||
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1