| 上传:郭晟化学 | 审核发布:admin | 更新时间:2016-12-30 10:46:01 | 点击次数:723次 |
|
课 题 |
金属的电化学腐蚀与防护 |
课 型 |
新授 |
|
课 时 |
1课时 |
主备课人 |
郭晟 |
|
复备课人 |
|
审核人 |
唐高明 |
|
课前准备 |
相关实验用品 |
||
|
教 学 目 标 |
知识与技能: 1、 掌握金属的电化学腐蚀和电极反应式的写法 2、知道金属的电化学防护的方法 |
||
|
过程与方法: 培养学生分析和解决生活生产中的问题的能力 |
|||
|
情感态度与价值观: 1、关心我国的基本化学国情,关注化学在生活中的实际应用,做到学以致用。 2、形成节约资源,循环利用资源的可持续发展观念。 |
|||
|
教学重点 |
电化学腐蚀与防护 |
||
|
教学难点 |
析氢腐蚀和吸氧腐蚀 |
||
|
教学过程和教学内容 |
二次备课 |
||
|
[导入]从金属腐蚀的危害导入课堂 [指导阅读] 1、什么是金属的腐蚀?金属腐蚀的本质是什么? 2、金属腐蚀的分类? 3、有哪些金属的防护方法? 一、金属腐蚀: 1、定义:是指金属或合金跟接触的气体或液体发生氧化还原反应而腐蚀损耗的过程。 2、本质: M – ne- → Mn+(氧化反应) 3、类型:化学腐蚀——直接反应 电化学腐蚀——原电池反应 二、化学腐蚀 1、定义:金属与接触到的干燥气体(如 、 、 等)或非电解质液体(如 )等直接发生化学反应而引起的腐蚀。 如:钢管被原油中的 腐蚀, 2、影响因素:与接触物质的氧化性有关和温度越高,化学腐蚀越 。 三、电化学腐蚀 (以钢铁为例) 1、定义:不纯的金属跟电解质溶液接触时。会发生 反应 的金属失去电子而被 。如 在潮湿的空气中生锈。 [过渡]: 钢铁及其制品通常为含碳的铁合金,若在潮湿的环境里或湿度较大的环境里长期放置,常易生锈变红,是什么原因?下面我们就来讨论钢铁在潮湿的空气中生锈的原因? 2、析氢腐蚀 (酸性较强的溶液) 在酸性较强的溶液中发生电化腐蚀时放出氢气,这种腐蚀叫做析氢腐蚀。 负极: Fe – 2e- = Fe2+ 正极: 2H+ + 2e- = H2 ↑ 总式:Fe + 2H+ = Fe2+ + H2 ↑ 3、 吸氧腐蚀 (中性或弱酸性溶液) 金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀,叫吸氧腐蚀. 钢铁等金属的电化腐蚀主要是吸氧腐蚀. 负极: 2Fe – 4e- = 2Fe2+ 正极: O2+4e- +2H2O = 4OH- 总式:2Fe + O2 +2H2O =2 Fe(OH)2 后续反应:4 Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 2Fe(OH)3=Fe2O3·xH2O+(3-x) H2O 四、金属的防护 1、影响金属腐蚀快慢的因素
介质:环境(腐蚀性气体,电解质溶液) 2、 金属的防护 a) 改变金属的内部结构(钢→不锈钢,在钢中加入镍和铬) b) 覆盖保护膜(涂油漆,电镀,钝化等) c) 电化学保护 ①外加电流阴极保护法 ②牺牲阳极阴极保护法 五、影响金属腐蚀快慢比较
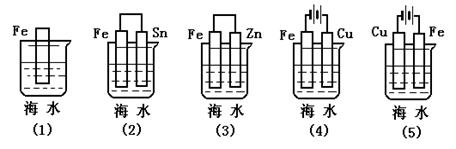
[典型例题]:上图各情况中Fe片腐蚀由快到慢的顺序是 5 2 1 3 4
[结 论]:1、原电池正极、电解池阴极受到保护 2、在同一电解质溶液中,金属腐蚀的快慢规律如下: 电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>防腐措施的腐蚀
|
|
||
|
教学札记:
|
|||
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1