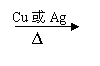| 上传:夏尊华化学 | 审核发布:admin | 更新时间:2015-6-2 22:30:34 | 点击次数:1373次 |
[设问] 通过计算,你认为这两种结构中哪一种是乙醇的分子结构呢?为什么?
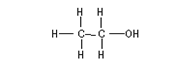
[提供的水和乙烷分子结构球棍模型]
[设问]请从结构上对比分析水、乙烷和乙醇,你能得出哪些结论?
回忆、讨论完成钠与水反应(P73)表格内容的填写
[实验探究]分组完成实验3—3
通过实验、观看、思考、讨论并完成钠与乙醇反应(P73)表格内容的填写和评价
CH3CH2OH+2Na![]()
2CH3CH2ONa+H2↑
——取代反应
[操作]组装并展示可能的C2H6O分子结构:
CH3-O-CH3和CH3CH2OH
通过组装、计算、分析得出:乙醇分子中有一个H与其他的H位置不同,能产生H2 是因为乙醇分子中有与O相连的H,写出乙醇的结构式
通过新旧知识的联系,培养知识迁移、扩展的能力,进一步激发学习的兴趣和求知欲望。培养学生观察实验,分析实验及实验数据的能力.并能很好的利用性质与物质结构的关系,从性质入手推测结构.
[提供材料3] 乙醇、乙烷和水的主要性质比较表:
|
物质 |
熔点/0C |
沸点/0C |
在水中溶解性 |
能否与钠反应 |
|
CH3CH3 |
-182.8 |
-88.6 |
难溶 |
否 |
|
CH3CH2OH |
-117.3 |
78.5 |
互溶 |
能 |
|
H2O |
0 |
100 |
/ |
能 |
[设问] 乙醇和乙烷在组成元素上有什么不同?为什么乙烷中的氢原子被-OH(羟基)取代后生成的乙醇,两者在性质上明显有差异?
[点拨]启发引导学生得出烃的衍生物及官能团的概念。
[设问]我们学习过的有机物中有哪些官能团呢?
通过对水、乙烷和乙醇分子组成、结构模型及相关资料的探究,得出结论:
①烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
②乙醇分子可以看成是乙烷分子中的一个氢原子被羟基(-OH)取代,也可以看作是水分子中的一个氢原子被乙基取代。
③在化学性质上乙醇与水有相似之处,如都能与钠反应;乙醇与乙烷相似之处是都能燃烧,不同之处表现在与钠的反应上。可见:决定乙醇化学特性的是羟基。像这种决定有机化合物的化学特性的原子或原子团叫官能团
明白卤素原子、羟基、硝基和碳碳双键都是官能团。
培养学生从结构预测物质化学性质的能力,进一步树立结构决定性质的思想
应
用
1.乙醇分子中的化学键如图所示: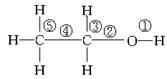
关于乙醇在各种不同反应中断裂键的情况为:
A、和金属钠反应,键______断裂
B、在Ag或Cu催化作用下和O2反应,键____和键____断裂
2.从上题练习中你悟出了什么规律性的认识?有什么好方法来掌握有机化学反应方程式的书写吗?
3.司机是否酒后驾车,可通过对其呼出的气体进行检验而查出,所利用的化学反应如下:2CrO3(红色)+3C2H5OH+3H2SO4
===Cr2(SO4)3(绿色)+3CH3CHO+6H2O
被检测的气体的成分是________,上述反应中的氧化剂是_________,还原剂是______。
思考、练习、讨论
借练习1归纳总结乙醇的性质和结构的关系。通过练习,让让学生进一步加深对“结构决定性质”的认识,自觉养成从结构上来掌握有机化合物的化学性质和化学方程式的书写;从性质上掌握用途,提高学习效率
作业:P76T1、2、3(选做),P76T8(必做)
课外作业:P77T10
生活中常见的有机物——乙醇
东安一中 郭晟
一、教材分析
本节课选自人民教育出版社的全日制普通高中课程标准实验教科书《化学2(必修)》第三章第三节《生活中两种常见的有机物》的第一课时。乙醇和乙酸与日常生活联系密切,是学生每天都能看到、听到、甚至用到的物质;同时,乙醇在初中化学中作为清洁燃料之一也介绍过,这些都使学生感到熟悉、亲切,可以增加学习的兴趣与热情。
乙醇是在学习了烃的代表物——甲烷、乙烯、苯后,第一个接触到的烃的衍生物,为后面的各个烃的衍生物的学习提供了典范。教材从学生生活实际和已有知识出发,安排了两个难度不大的实验,尽力渗透结构分析的观点,让学生通过学习来了解烃的衍生物和官能团的概念,了解乙醇的物理性质及其用途,掌握乙醇的分子结构和化学性质。建立烃的衍生物 “(组成)结构—性质—用途”的认识关系,使学生了解学习烃的衍生物的一般方法,形成一定的分析和解决问题的能力,提高学习有机化学的质量。
二、学情分析:
中学生进入高中阶段,其学习思想从“被动接受型”慢慢向“自主学习型”转变。他们学习思维的广阔性、深刻性、逻辑性和创造性明显增加,学习动机比较稳定。他们在初中虽已接触了一些常见有机物的知识,有一定的学习基础,但本节课首次提出了“官能团”的概念,围绕“官能团(结构)—性质”的关系展开,难度较大。因此,在教学过程中一方面要注意教学过程的逻辑性,同时用实验探究辅助教学,来吸引学生的注意力,对学生进行科学素质的培养。在“搭建平台”时要注意高视角、低起点,由浅入深,从学生认识基础出发,适当补充课堂探究用的资料,加强直观性教学,采用设问、类比启发等方式,重点点拨并辅以师生讨论的方法,引导学生去联想、运用迁移规律,使学生在轻松的环境中掌握新知识;训练时要教给学生分析问题、解决问题的方法,帮助学生提高学习的质量和效率。
二、教学设计
1、教学流程图:
课堂教学程序:问题―→探究 ―→应用
学生(主体性):提出问题―→自主探究―→应用巩固
交往↑↓互动 启发↑↓反馈 启发↑↓反馈 启发↑↓反馈
教师(主导性):创设情境―→搭建平台―→提供问题(习题)
2、设计思路:
(1)在“问题”阶段:通过生活中流行的“醋能解酒”的观点来创设探究氛围,启发学生大胆质疑“醋真的能解酒吗”?激发学生的探究欲望,引导学生对生活中两种常见有机物——乙醇和乙酸的探究学习。
(2)在“探究”阶段:通过展示资料、样品,并结合初中化学的复习来完成乙醇的物理性质和在生产生活中的应用的学习;通过实验、球棍模型和相关资料来完成乙醇的分子结构和主要化学性质探究学习;并启发引导学生讨论,归纳得出烃的衍生物和官能团的概念。从而培养学生的思维能力和实验能力。
(3)在“应用”阶段:通过对习题问题的解决来归纳小结乙醇的结构与性质的关系,帮助学生掌握学习方法,深化知识运用,提高学习质量。演练时要注意面向全体学生,力争人人有收获。
三、教 案
|
课题 |
生活中的常见有机物——乙醇 |
授课人 |
郭晟 |
学校 |
东安县第一中学 |
||||
|
教
学
目
标 |
1.知识与技能: (1) 了解乙醇的物理性质和在生产生活中的应用。 (2) 了解烃的含氧衍生物、官能团的概念。 (3) 掌握乙醇的分子结构和化学性质—与钠的反应、氧化反应。 2.过程与方法: (1) 通过有关乙醇的实验,提高学生观察化学实验现象、分析实验结果的能力。 (2) 从乙醇的组成、结构和性质出发,掌握烃的衍生物的学习方法(结构—性质—用途)。 3.情感态度价值观: (1) 通过比较乙烷和乙醇结构、性质的差异,认识官能团决定有机物的性质;从乙醇在日常生活、生产中的广泛应用,形成运用知识解决实际问题的意识。 (2)通过实验探究,提高实验能力、观察能力和分析解决问题的能力,培养求实、严谨的优良品质。 (3) 通过新旧知识的联系,培养知识迁移、扩展的能力,进一步激发学习的兴趣和求知欲望。 |
||||||||
|
重点 |
官能团的概念、乙醇的分子结构和主要化学性质——取代反应与氧化反应 |
||||||||
|
难点 |
使学生建立乙醇分子的立体结构模型,并能从结构角度初步认识乙醇的反应实质 |
||||||||
|
教学方法 |
启发――探究 |
||||||||
|
教学用品 |
药品:钠、无水乙醇、澄清石灰水、铜丝。 仪器:烧杯、试管、带注射针头的单孔橡胶塞、试管夹、酒精灯。 (按分组实验准备) 用具:投影仪,水、乙烷和乙醇分子结构的球棍模型 |
||||||||
|
教学流程 |
教 师 活 动 |
学 生 活 动 |
设 计 意 图 |
||||||
|
问
题 |
[设问] 你在家喝过酒吗?你听说过“醋能解酒”吗?你认为这种观点对吗? [点拨]这种观点对不对,要让科学来说话。请同学们带着这个问题来认识下生活中常见的两种有机物——乙醇和醋酸,看看这个观点究竟对不对。 |
思考、猜测、讨论
猜想:醋真的能解酒吗? |
从生活走进化学,创设问题情景,激发求知欲望和探究兴趣。 |
||||||
|
探
究
|
[设问]通过生活和初中化学的学习,你对“酒”知道了多少?无水乙醇具有怎样的物理性质呢? [提供资料1]酒是多种化学成分的混合物,其主要成分是酒精,酒精的学名是乙醇、化学式是CH3CH2OH,啤酒中乙醇含量为3%~5%,葡萄酒含酒精6%~20%,黄酒含酒精8%~15%,一些烈性白酒中含乙醇50%~70%。(均为体积分数)。乙醇具有加速人体的血液循环、兴奋神经的作用。过量饮酒会造成酒精中毒,有害健康。乙醇具有杀菌消毒作用,75%的酒精可用于医疗消毒。乙醇能燃烧,可作为燃料,因为其燃烧值高,燃烧产物无污染,是很有前景的清洁能源,如车用乙醇汽油等。 [出示无水乙醇样品] [板书] (一)乙醇的物理性质 [设问]瓶装白酒不喝时,为什么要盖上瓶盖密封保存?为什么把名贵药材放入白酒中浸泡可制成药酒? |
认真回忆、阅读、观察、讨论交流,归纳总结乙醇的物理性质:无色、易挥发、有特殊香味的液体,密度、熔点、沸点均小于水,能溶解多种有机物和无机物,能与水以任意比例互溶 |
学生通过阅读、观察,启动对“酒”(乙醇)的探究,培养学生的观察能力和思维能力,体验“性质决定用途”
促使学生养成运用知识解决实际问题的意识 |
||||||
|
[设问]通过初中化学的学习,你能写出乙醇的化学式吗?你知道乙醇具有什么化学性质?你能写出乙醇燃烧的化学方程式吗?这个反应是氧化反应吗? [板书] (二)乙醇的化学性质 1.乙醇的氧化反应 ①乙醇的燃烧:(学生写出反应方程式) [设问]乙醇能与氧气发生剧烈的氧化反应——燃烧外,还能不能与氧化剂发生较为温和的氧化反应呢? [板书]②催化氧化:(引导学生写出反应方程式) [设问]乙醇与强氧化剂(如酸性高锰酸钾溶液)反应的产物是什么?
[板书]③与强氧化剂(如酸性高锰酸钾溶液)反应→乙醛→乙酸 |
思考、回答并写出乙醇燃烧的化学方程式:
[实验探究]分组完成实验3—3 通过实验、观看(红→黑→红和刺激性气味)、思考、归纳: 2CH3CH2OH + O2
2CH3CHO + 2H2O 可被先氧化成乙醛,最终氧化成乙酸 |
|
|||||||
|
[设问] 大家回忆下,金属钠与水反应的实验现象怎样? [设问]金属钠与乙醇能反应吗?现象怎样?这说明了什么问题? [鼓励]看哪组的同学完成得又好又快!相信你对比水与金属钠的反应方程式,一定能写出钠与乙醇反应的化学方程式 [展示评价]投影学生填写的表格,引导学生进行评价 [设问]水与乙醇都能和钠发生反应,可能的原因是什么?钠与乙醇的反应是什么类型? [点拨]我们在初中常写的乙醇的化学式实际上是乙醇的结构简式(C2H5OH或CH3CH2OH),它的分子式是C2H6O [设问]你能用桌子上的球棍材料组装出乙醇分子的结构模型吗?你能组装出几种不同的分子结构? [提供材料2]实验证明:“46克
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438 Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1
| |||||||||