| 上传:夏尊华化学 | 审核发布:admin | 更新时间:2016-1-22 18:14:42 | 点击次数:363次 |
|
课 题 |
化学反应热的计算 |
课 型 |
新授 |
|
|
课 时 |
第1课时 |
主备课人 |
郭晟 |
|
|
复备课人 |
|
审核人 |
唐高明 |
|
|
课前准备 |
相关实验用品 |
|||
|
教 学 目 标 |
知识与技能: 1.从能量守恒角度理解并掌握盖斯定律; 2.能正确运用盖斯定律解决具体问题; |
|||
|
过程与方法: 通过运用盖斯定律求有关的反应热,进一步理解反应热的概念。 |
||||
|
情感态度与价值观: 通过实例感受盖斯定律,并以此说明盖斯定律在科学研究中的重要作 |
||||
|
教学重点 |
盖斯定律 |
|||
|
教学难点 |
盖斯定律的应用 |
|||
|
教学过程和教学内容 |
二次备课 |
|||
|
[引入]某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。在生产 [板书] 第三节 化学反应热计算 一、盖斯定律 [投影]
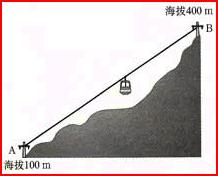
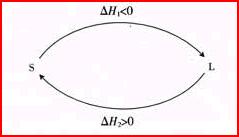
[讲]根据图示从山山的高度与上山途径无关及能量守衡定律来例证盖斯定律。 [活动]学生自学相关内容后讲解 [板书]1、 盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。 [讲]盖斯定律在生产和科学研究中有很重要的意 [板书]2、盖斯定律在生产和科学研究中有很重要的意义 [科学探究]对于反应:C(s)+
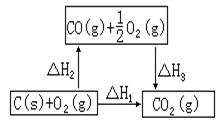
[师生共同分析]我们可以测得C与O2反应生成CO2以及CO与O2反应生成CO2的反应热:C(s)+O2(g) =CO2(g);ΔH=-393.5 kJ/mol CO( [投影]
[讲 ∵ΔH1=ΔH2+ΔH3∴ΔH2=ΔH1-ΔH3=-393.5kJ/mol-(-283.0kJ/mol)=-110.5
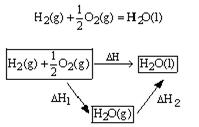
kJ/mol即:C(s)+ 例1、通过计算求的氢气的燃烧热:可以通过两种途径来完成 如上图表: 已知:H2(g)+ H2O(g)=H2O(l);△H2=-44.0kJ/mol 根据盖斯定律,则 △H=△H1+△H2=-241.8kJ/mol+(-44.0kJ/mol)=-285.8kJ/mol 【小结】(1)写出目标方程式确定“过渡物质” (要消去的物质) (2)然后用消元法逐一消去“过渡物质”,导出“四则运算式”。 例2、 已知①CO(g)+1/2O2(g)= CO2(g); ΔH1= -283.0 kJ/mol ② H2(g) + 1/2 O2(g) = H2O(l)
; ΔH2= ③C2H5OH(l) + 3 O2(g)
= 2 CO2(g) + 3H2O(l); ΔH3=-1370
kJ/mol ④2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH (l) 的ΔH 【解】:①×2 + ②×4 - ③
= ④
|
|
|||
|
教学札记:
|
||||
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1