| 上传:夏尊华化学 | 审核发布:admin | 更新时间:2016-1-22 21:54:01 | 点击次数:364次 |
|
课 题 |
化学平衡图像 |
课 型 |
习题课 |
|
|
课 时 |
课时 |
主备课人 |
袁希望 |
|
|
复备课人 |
|
审核人 |
袁希望 |
|
|
课前准备 |
|
|||
|
教 学 目 标 |
知识与技能:知道平衡图像的解题思路,能结合移动原理进行解题。 |
|||
|
过程与方法:通过平衡图像的解题,培养学生分析问题和解题问题的方法。 |
||||
|
情感态度与价值观:体验化学中逻辑分析的乐趣,培养学生热爱化学的心理。 |
||||
|
教学重点 |
平衡图像的解题技巧 |
|||
|
教学难点 |
平衡图像的解题技巧 |
|||
|
教学过程和教学内容 |
二次备课 |
|||
|
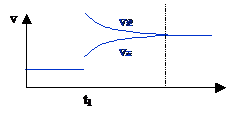
一.解题方法 1.五看:一看面:认清坐标系,搞清纵、横坐标所代表的意义。 二看点(即起点、折点、交点和终点)。 三看线(即线的走向和变化趋势)。 四看辅助线(如等温线、等压线、平衡线等), 五看量的变化(如温度、浓度、压强、转化率等的变化趋势)。 2.紧扣可逆反应的特征,搞清正反应方向是吸热还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。 3.利用化学平衡移动原理解题。 二.具体题型解题技巧 1.速率—时间图像:利用平衡移动规律解题 2.浓度(物质的量、转化率、百分含量)—时间图像:“先拐先平数值大”,先达到拐点,则速率快对应压强大、温度快、加入催化剂。 3.浓度(物质的量、转化率、百分含量)—压强或温度:“定一议二”。 【典型例题】 例1. 对于反应A(g)+3B(g)
解析:由于v正、v逆均有不同程度的增大,引起平衡移动的因素可能是 :a.升高温度;b.增大压强。根据反应方程式,正反应是体积减小的放热反应,则升高温度平衡向逆反应方向移动,与图示相符;增大压强平衡向正反应方向移动,与图示不相符。故此题中引起平衡移动的因素是升高温度。 答案:引起平衡移动的因素是升高温度。正反应是体积减小的放热反应,则升高温度平衡向逆反应方向移动。 例4. 对于m A (g)+ n B (g)
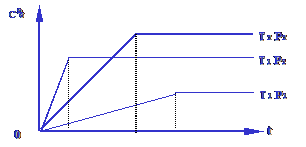
则:①P1与 P2 的关系是 ; ②m + n 与p的关系是 ; ③T1 与 T2的关系是 ; ④Q与 0 的关系是 。 解析:本题解答时应遵循两个原则:“先拐先平”“定一议二”原则。在温度均为T1时,P2达到平衡需要的时间短,因此P2>P1;压强越大,C的百分含量越大,说明正反应是体积增大的反应,即m + n >p;在P2保持不变时,T1达到平衡需要的时间短,因此T1> T2,温度越高,C的百分含量越小,而升高温度平衡向吸热反应方向移动,说明正反应是放热反应,即Q小于0。 答案:P2>P1;m + n >p;T1> T2;Q小于0。 例3. 有一化学平衡mA(g)+nB(g) (1)正反应是放热还是吸热反应?(2)m+n与p+q的大小.
解析:用到“定一议二”。固定压强,讨论T与A的转化率的关系:同一压强下温度越高,A的转化率越高,说明正反应是吸热反应;固定温度,讨论P与A的转化率的关系:同一温度下,压强越大,A的转化率越高,说明正反应是体积缩小的反应,即m+n>p+q。 答案:正反应是吸热反应;m+n>p+q。 |
|
|||
|
教学札记: |
||||
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1