| 上传:夏尊华化学 | 审核发布:admin | 更新时间:2016-1-22 18:02:51 | 点击次数:371次 |
|
课 题 |
化学反应与能量的变化 |
课 型 |
新授 |
|
|
课 时 |
第1课时 |
主备课人 |
郭晟 |
|
|
复备课人 |
|
审核人 |
唐高明 |
|
|
课前准备 |
相关实验用品 |
|||
|
教 学 目 标 |
知识与技能: 1. 使学生了解化学反应中能量转化的原因和常见的能量转化形式; 2. 了解反应热和焓变的涵义; |
|||
|
过程与方法: 1. 通过对学习资料的查找与交流,培养学生获取信息、理解信息并得出结论 的能力以及语言表达能力; 2. 通过从化学键的角度分析化学反应,引导学生分析引起反应热的本质。 |
||||
|
情感态度与价值观: 激发学生的学习兴趣,培养学生从微观的角度理解化学反应,培养学生尊重科学、严谨求学、勤于思考的态度,树立透过现象看本质的唯物主义观点 |
||||
|
教学重点 |
化学反应中的能量变化及其微观原因 |
|||
|
教学难点 |
化学反应中的能量变化及其微观原因 |
|||
|
教学过程和教学内容 |
二次备课 |
|||
|
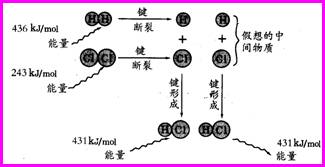
[回忆]化学键在形成和断裂的过程中能量的变化 一、反应热 焓变: 在化学反应过程中放出或吸收的热量、通常叫做反应热。又称焓变。 (1)符号:用△H表示。 (2)单位:一般采用kJ/mol。 (3)可直接测量,测量仪器叫量热计。 (4)研究对象:一定压强下,在敞口容器中发生的反应所放出或吸收的热量。 (5)反应热产生的原因: [设疑]例如:H2(g)+Cl2(g) = 2HCl(g) 实验测得 lmol H2与 lmol Cl2反应生成 2 mol HCl时放出184.6 kJ的热量,从微观角度应如何解释? [电脑投影] [析疑] 化学键断裂时需要吸收能量。吸收总能量为:436kJ+243kJ=679 kJ, 化学键形成时需要释放能量。释放总能量为:431kJ+431kJ=862 kJ, 反应热的计算:862kJ—679kJ=183kJ [讲述]任何化学反应都有反应热,这是由于反应物中旧化学键断裂时,需要克服原子间的相互作用而吸收能量;当原子重新组成生成物、新化学键形成时,又要释放能量。新化学键形成时所释放的总能量与反应物中旧化学键断裂时所吸收的总能量的差就是此反应的反应热。 [板书] (6)反应热表示方法: [学生阅读教材小结]①当生成物释放的总能量大于反应物吸收的总能量时,反应为放热反应,使反应本身能量降低,规定放热反应△H为“一”,所以△H为“一”或△H<0时为放热反应。 上述反应 H2(g)+Cl2(g) = 2HCl(g),反应热测量的实验数据为 184.6 kJ/mol,与计算数据 183kJ/mol很接近,一般用实验数据表示,所以△H =-184.6 kJ/mol。 ②当生成物释放的总能量小于反应物吸收的总能量时,反应是吸热反应,通过加热、光照等方法吸收能量,使反应本身能量升高,规定△H为“+”,所以△H为“+”或△H>0时为吸热反应。 [板书] △H为“+”或△H>0时为吸热反应;△H为“一”或△H<0时为放热反应。 [投影]
[讲解] (1)如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出热量。反应为放热反应。规定放热反应△H为“一”。 (2)如果反应物所具有的总能量小于生成物所具有的总能量,反应物转化为生成物时吸收热量。反应为吸热反应。规定△H为“+”。 [投影] 例 1:1molC与1molH2O(g)反应失成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。(+131.5) 例 2:拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946N,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。 分析:N2(g)+3H2(g)=2NH3(g),因拆开 lmol N—H键和生成 lmol N—H键吸收和释放出的能量相等,所以此反应的反应热计算如下: 2×3×391kJ/mol-946kJ/mol-3×436kJ/mol=92kJ/mol
而 lmol H2只与
|
|
|||
|
教学札记:
|
||||
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1