| 上传:夏尊华化学 | 审核发布:admin | 更新时间:2016-1-22 22:12:18 | 点击次数:381次 |
|
课 题 |
原电池 |
课 型 |
新授 |
|||||||||||||||||
|
课 时 |
1课时 |
主备课人 |
郭晟 |
|||||||||||||||||
|
复备课人 |
|
审核人 |
唐高明 |
|||||||||||||||||
|
课前准备 |
相关实验用品 |
|||||||||||||||||||
|
教 学 目 标 |
知识与技能: 1.了解原电池的工作原理和双液原电池 2.知道原电池原理的一些应用; |
|||||||||||||||||||
|
过程与方法: 培养学生观察能力、实验能力、实验设计能力、语言表达能力。培养学生正向思维、逆向思维、发散思维能力。 |
||||||||||||||||||||
|
情感态度与价值观: 培养学生的探究精神和依据实验事实得出结论的科学态度,培养学生的团队协作精神。 |
||||||||||||||||||||
|
教学重点 |
原电池的原理 |
|||||||||||||||||||
|
教学难点 |
双液原电池的原理 |
|||||||||||||||||||
|
教学过程和教学内容 |
二次备课 |
|||||||||||||||||||
|
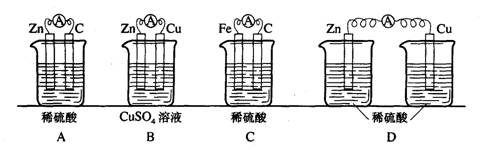
[知识回顾]一、原电池的原理
[设疑]1.哪种装置可以形成原电池? 2.指出正、负极溶液上各发生什么变化? 3.电子的流动方向如何? [学生讨论](A、B、C可形成原电池) [讨论]通过以上做的几个实验,总结一下组成原电池的条件及原理。 (学生发言后小结) [板书]1、原电池的定义:化学能转变为电能的装置。 2、组成原电池的条件 ①有两种活动性不同的金属(或一种是非金属导体)作电极 ②电极材料均插入电解质溶液中 ③两极相连形成闭合电路 3、原电池的原理:较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属(正极)。 [投影](学生填写下表)
[思考]该电池能得到持续稳定的电流吗?为什么? 否。 由于锌片与硫酸铜溶液直接接触,难免有铜在锌片表面析出,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,不再构成原电池,也就没有电流产生。 [实验设计]在原有实验基础上进行改进,设计成一个能产生持续稳定电流的原电池。 4、双液原电池(实验4-1) 盐桥的作用: 二、原电池原理的应用 1、加快反应速率 2、比较金属活动性强弱 3、设计原电池 |
|
|||||||||||||||||||
|
教学札记:
|
||||||||||||||||||||
通讯地址: 广州市天河区东圃黄村龙怡苑 (510660)邮箱:lzm6308@163.com 联系QQ:534386438
Copyright © 2008-2012 klxkc.com All Rights Reserved. 粤ICP备15026984号-1